
科目: 来源: 题型:
【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
①能说明该反应已达到平衡状态的标志是___。
a.反应速率v(NH3)=v(N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O)=6∶4∶5∶6
e.12mol N-H键断裂的同时生成5mol N≡N键
②某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是v(正)___v(逆);d点对应的速率关系是v(正)___v(逆)。(填﹥、﹤或﹦)。

(2)一定条件下,在2L密闭容器内,反应2NO2(g)![]() N2O4(g),n(NO2)随时间变化如下表:
N2O4(g),n(NO2)随时间变化如下表:

①用N2O4表示0~2s内该反应的平均速率为___。在第5s时,NO2的转化率为___。
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学元素形成的单质或化合物在工农业生产、军事国防、医疗生活各个领域发挥着重要的作用。
(1)钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82—+8H2O![]() 2MnO4—+10SO42—+16H+
2MnO4—+10SO42—+16H+
①基态S原子核外有____种不同空间运动状态的电子。
②已知H2S2O8的结构如图所示:

H2S2O8中硫原子的轨道杂化方式为________;上述反应每生成1molMnO4—,S2O82—断裂的共价键类型及其数目分别为________、__________(设阿伏伽德罗常数的值为NA)
(2)Fe可以与CN—、H2NCONH2(尿素)等多种配体形成配合物。
①请写出与CN—互为等电子体的一种分子:______、一种离子:_________。
②组成尿素的第二周期元素的第一电离能由大到小的顺序为:________,1molH2NCONH2(尿素)分子中含有σ键的数目为_______。
③FeN的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或b位置Fe,形成Cu替代型产物Fe(x—n)CunNy。

Cu处于周期表中_____区,其最高能层的符号为____,基态铜原子的价电子排布式为________。FexNy转化为两种Cu的替代型产物的能量变化如图2所示,其中相对不稳定的Cu替代型产物的化学式为_________。
(3)铬是银灰色的结晶体,质硬而脆,是制造不锈钢、高速钢的重要原料。
①CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是____(填“极性”或“非极性”)分子
②CrCl3·6H2O实际上是配合物,配位数是6,其固体有三种颜色,其中一种浅绿色固体于足量硝酸银反应时,1mol固体可生成1molAgCl沉淀,则这种浅绿色固体中阳离子的化学式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑之一。
(1)X、Y、Z、W、R均是1-18号元素,原子序数依次增大。X是所有元素中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R电子层数相同,R与Y最外层电子数相同,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相同。请回答下列问题:
①W的原子结构示意图__,R离子的电子式__。
②X与Y元素可形成一种常用的消毒剂,其结构式为_。
③Y、Z、W、R形成的简单离子半径由大到小顺序为__(用化学符号表示)。
(2)最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,相对原子质量是85。根据材料回答下列问题:
①铷在元素周期表中的位置__。
②关于铷的下列说法中正确的是__(填序号)。
a.与水反应比钠更剧烈
b.在空气中易吸收水和二氧化碳
c.Rb2O2与水能剧烈反应并释放出O2
d.单质具有很强的还原性
e.RbOH的碱性比同浓度的NaOH弱
(3)为验证第ⅦA族部分元素非金属性的递变规律,设计如图装置进行实验,请回答:
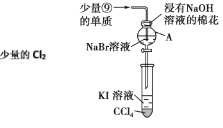
①棉花中浸有NaOH溶液的作用是__(用离子方程式表示)
②验证溴与碘的非金属性强弱:通入少量氯气,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到__;该实验必须控制氯气的加入量,否则得不出溴的非金属性比碘强的结论,理由是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。

(1)Fe还原水体中NO3-的反应原理如图1所示。
①作负极的物质化学式为___________。
②正极的电极反应式是_________________________________________。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是_____________________________________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图2所示,可得到的结论是____________________。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为_________,解释加入Fe2+提高NO3-去除率的原因:_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列提供的一组物质回答问题:
①NH4Cl ②MgCl2 ③H2S ④Na2O2 ⑤MgO ⑥Cl2 ⑦NaOH ⑧H2O2 ⑨NH3 ⑩CO2
(1)既有极性共价键又有非极性共价键的是__(用序号表示)。
(2)既有离子键又有共价键的是__(用序号表示)。
(3)共价化合物有___(用序号表示)。
(4)CO2的电子式___;Na2O2的电子式__。
(5)用电子式表示MgCl2的形成过程:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯胺![]() 是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
已知:①![]() 和NH3相似,与盐酸反应生成易溶于水的盐
和NH3相似,与盐酸反应生成易溶于水的盐![]()
②用硝基苯制取苯胺的反应原理: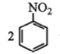 +3Sn+12HCl
+3Sn+12HCl![]()
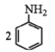 +3SnCl4+4H2O
+3SnCl4+4H2O
③有关物质的部分物理性质见下表:

I.比较苯胺与氨气的性质
(1)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近,产生白烟,反应的化学方程式为____;用苯胺代替浓氨水重复上述实验,却观察不到白烟,原因是____。
Ⅱ.制备苯胺
往图1所示装置(夹持装置略,下同)的冷凝管口分批加入20mL浓盐酸(过量),置于热水浴中回流20min,使硝基苯充分还原;冷却后,往三颈烧瓶中滴入一定量50% NaOH溶液,至溶液呈碱性。
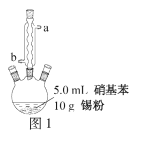
(2)冷凝管的进水口是____(填“a”或“b”);
(3)滴加NaOH溶液的主要目的是析出苯胺,反应的离子方程式为____。
Ⅲ.提取苯胺
i.取出图1所示装置中的三颈烧瓶,改装为图2所示装置。加热装置A产生水蒸气,烧瓶C中收集到苯胺与水的混合物;分离混合物得到粗苯胺和水溶液。

ii.往所得水溶液中加入氯化钠固体,使溶液达到饱和状态,再用乙醚萃取,得到乙醚萃取液。
iii.合并粗苯胺和乙醚萃取液,用NaOH固体干燥,蒸馏后得到苯胺2.79g。
(4)装置B无需用到温度计,理由是____。
(5)操作i中,为了分离混合物,取出烧瓶C前,应先打开止水夹d,再停止加热,理由是____。
(6)该实验中苯胺的产率为____。
(7)欲在不加热条件下除去苯胺中的少量硝基苯杂质,简述实验方案:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下:
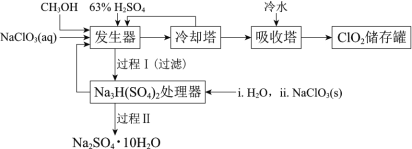
已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH=12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2Ob.相关物质的熔沸点:

(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有_____性。
(2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为 ______________(填字母)。
a.0~10℃ b.20~30℃ c.60~70℃
(3)可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如图:

① Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因 __(结合方程回答)。
②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,_______。
③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和_____。
(4)为测定存储罐中所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇 匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
①准确量取10.00 mL ClO2溶液的玻璃仪器是______。
②若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果_____ (填“偏高”、“偏低”或“无影响”)
③根据上述步骤可计算出原ClO2溶液的浓度为_____mol·L-1(用含字母的代数式表示)。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。ClO2的有效氯含量为_______。(计算结果保留两位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。放电时总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
①写出放电时负极的电极反应式:__。
②铅蓄电池放电时,溶液的pH将_(填增大、减小或不变);当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为__。
(2)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为___;若将负极材料改为CH4,写出其负极反应方程式__。

(3)法国格勒诺布尔(Grenoble)约瑟夫﹒傅立叶大学的研究小组发明了第一块可植入人体为人造器官提供电能的葡萄糖生物燃料电池,其基本原理是葡萄糖和氧气在人体中酶(蛋白质)的作用下发生反应:C6H12O6+6O2![]() 6CO2+6H2O(酸性环境)。下列有关该电池的说法正确的是__。
6CO2+6H2O(酸性环境)。下列有关该电池的说法正确的是__。
A.该生物燃料电池不能在高温下工作
B.该电池负极的电极反应式为:C6H12O6+6H2O-24e-=6CO2↑+24H+
C.消耗1mol氧气时转移4mol电子,H+向负极移动
D.提高葡萄糖生物燃料电池的效率,可使其在将来为更多可植入医疗设备提供电能
(4)1958年世界上第一个心脏起搏器在瑞典植入人体成功,使用寿命长达10年之久。这种能源起搏器中安装寿命最长、可靠性最高的锂—碳电池,这种电池容量大,电压稳定,能在-56.7~71.1℃温度范围内正常工作。现已在火箭、移动电话、笔记本电脑中广泛使用。它采用锂和石墨作电极,四氯化铝锂(LiAlCl4)溶解在亚硫酰氯中(SOCl2)组成电解质溶液。电池总反应为:8Li+3SOCl2=6LiCl+Li2SO3+2S,此电池中___作正极,负极的电极反应为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物对环境具有显著影响。
(1)已知汽车气缸中氮及其化合物发生如下反应:
①N2(g)+O2(g) 2NO(g) △H=+180 kJ/mol
②N2(g)+2O2(g) 2NO2(g) △H=+68 kJ/mol
则2NO(g)+O2(g) 2NO2(g) △H=_____kJ/mol
(2)对于反应2NO(g)+O2(g) 2NO2(g)的反应历程如下:
第一步:2NO(g)![]() N2O2(g)(快速平衡)
N2O2(g)(快速平衡)
第二步:N2O2(g)+O2(g)![]() 2NO(g)(慢反应)
2NO(g)(慢反应)
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:υ正=k1 正·c2(NO),υ 逆=k1 逆·c(N2O2),k1正、k1 逆为速率常数,仅受温度影响。下列叙述正确的是_____
a.整个反应的速率由第一步反应速率决定
b.同一温度下,平衡时第一步反应的![]() 越大,反应正向程度越大
越大,反应正向程度越大
c.第二步反应速率慢,因而平衡转化率也低
d.第二步反应的活化能比第一步反应的活化能高
(3)将氨气与二氧化碳在有催化剂的反应器中反应![]() △H=-87.0 kJ/mol,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
△H=-87.0 kJ/mol,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:

①a点_____(填是或不是)处于平衡状态,T1之后尿素产率下降的原因可能是 _____________。
②实际生产中,原料气带有水蒸气,图2表示CO2的转化率与氨碳比![]() 、水碳比
、水碳比![]() 的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是_____,测得b点氨的转化率为30%,则x=______________。
的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是_____,测得b点氨的转化率为30%,则x=______________。
(4)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:N2H4+H2ON2H5++OH- K1=![]() ;N2H5++H2ON2H62++OH - K2=
;N2H5++H2ON2H62++OH - K2=![]() ;
;
①25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+ )>c(N2H4 ),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围__________(用含a、b式子表示)。
②水合肼(N2H4·H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是部分短周期元素原子半径与原子序数的关系如图,则下列说法正确的是( )
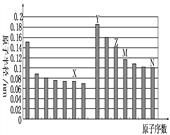
A . Z、N两种元素形成的化合物熔融状态下可以导电
B.X、N两种元素的气态氢化物的沸点相比,前者较低
C.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液中
D.由X与M两种元素组成的化合物能与水反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com