
科目: 来源: 题型:
【题目】汽车尾气中含有CO、NO等有害气体,某新型催化剂能促使NO、CO转化为2种无毒气体。T℃时,将0.8 mol NO和0.8 mol CO充入容积为2 L的密闭容器中,模拟尾气转化,容器中NO物质的量随时间变化如图。

(1)将NO、CO转化为2种无毒气体的化学方程式是__________________。
(2)反应开始至10 min,v(NO)=______mol/(Lmin),NO的转化率为________,此温度下达到平衡常数为________________。
(3)下列说法正确的是______。
a.新型催化剂可以加快NO、CO的转化
b该反应进行到10 min时达到化学平衡状态
c.平衡时CO的浓度是0.4 mol/ L
查看答案和解析>>
科目: 来源: 题型:
【题目】电能是现代社会应用最广泛的能源之一。

(1)某原电池装置如图所示。其中,Zn电极为原电池的______极(填“正”或“负”),电极反应式是______。Cu电极上发生的反应属于______(填“氧化”或“还原”)反应。电子由______极流出(Zn或Cu),电解质溶液中SO![]() 移向______(Zn或Cu)。
移向______(Zn或Cu)。
(2)下列反应通过原电池装置,可实现化学能直接转化为电能的是______(填序号)。
①CaO+H2O=Ca(OH)2
②2H2+O2 =2H2O
③2FeCl3+Cu=CuCl2+2FeCl2
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的消毒剂,可用ClO2为原料制取。某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。

已知:饱和NaClO2溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时 NaClO2分解成NaClO3和NaCl。Ba(ClO2)2可溶于水。利用如图所示装置进行实验。
(1)装置①的作用是________,装置④中反应生成NaClO2的离子方程式为______ 。
(2)从装置④反应后的溶液中获得NaClO2晶体的操作步骤为:①_______,55 ℃蒸发结晶;②趁热过滤;③用38~60 ℃的温水洗涤;④___________________,得到成品。如果撤去④中的冷水浴,可能导致产品中混有的杂质是______________。
(3)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4 : _______________________。
(4)为了测定NaClO2粗品的纯度,取10.0 g上述初产品溶于水配成1 L溶液,取出10 mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1的Na2S2O3标准液滴定,达到注定终点时的现象为:_____________________________________________。重复3次,消耗Na2S2O3溶液的体积依次为:19.50 mL、20.50 mL、22.00 mL,则NaClO2粗品的纯度为_____。(提示:2Na2S2O3+I2=Na2S4O6+2NaI)。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质溶液导电能力越强,电导率越大。常温下用0.1000 mol/L盐酸分别滴定10.00 mL浓度均为0.1000 mol/L的NaOH溶液和二甲胺[(CH3)2NH]溶液{二甲胺在水中电离与氨相似,已知在常温下Kb[(CH3)2NH·H2O]=1.6×10-4},利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A.盐酸滴定二甲胺实验中选择酚酞作指示剂比选甲基橙误差更小
B.d点溶液中:c(H+)>c(OH-)+c[(CH3)2NH2+]
C.b、c、d、e四点的溶液中,水的电离程度最大的是d点
D.a点溶液与d点的溶液混合后的溶液中: c(OH-) < c(H+) < c[(CH3)2 NH2+] <c(Na+)< c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
【题目】前四周期元素A、B、C、D、E原子序数依次增大。已知:A、C同主族,A的原子最外层电子数是次外层的3倍,B的氧化物既能溶于强酸,又能溶于强碱,D的原子半径是第3周期中最小的,E是形成骨骼和牙齿的主要元素,且E单质能和水反应。则下列分析错误的是
A.A和 B形成的化合物可作为耐火材料
B.A和C的氢化物的沸点:C>A
C.简单离子半径:E<D<C
D.E和D形成的化合物的电子式:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】《科学美国人》评出的2016年十大创新技术之一是碳呼吸电池,电池原理如图所示,则下列有关说法正确的是

A.以此电池为电源电解精炼铜,当有0.1 mol 电子转移时,有3.2 g铜溶解
B.正极每消耗4.48L的CO2,则生成0.1molC2O42-
C.每生成1 mol Al2(C2O4)3,有6 mol电子流过草酸盐溶液
D.随着反应进行,草酸盐浓度不变
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学进行如下实验,研究化学反应中的热量变化。

请回答下列问题:
(1)反应后①中温度升高,②中温度降低。由此判断铝条与盐酸的反应是________反应(填“放热”或“吸热”,下同),Ba(OH)2·8H2O与NH4Cl的反应是________反应。
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为______,表示其中和热的热化学方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g) ![]() 2C(g)+2D(g)ΔH=Q,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g)ΔH=Q,2 min末达到平衡,生成0.8 mol D。
(1)300 ℃时,该反应的平衡常数表达式为:K=______。已知K300 ℃<K350 ℃,则ΔH______0(填“>”或“<”)。
(2)若温度不变,缩小容器容积,则A的转化率________(填“增大”“减小”或“不变”),原因是_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)请用序号填空:
①13C与14C ②正丁烷与异丁烷
③CH3CH3与CH3CH2CH3 ④![]()
属于同位素的是______;属于同系物的是______;属于同分异构体的是______。
(2)写出下列物质的电子式:
NaCl____________ NH3______________
(3)第三周期元素中的最高价氧化物对应的水化物中,酸性最强的是______,碱性最强的是___________,呈两性的氢氧化物是___________。半径最大的原子是___________,氢化物最稳定的元素是__________。
(4)1molN2(g)与适量O2(g)反应生成NO(g),需吸收68kJ的热量,写出该反应的热化学方程式______________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用乙酸和乙醇在浓硫酸作用下制取乙酸乙酯的装置如图。下列说法正确的是
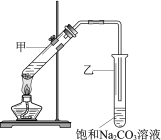
A. 向甲试管中先加浓硫酸,再加乙醇和乙酸
B. 乙试管中导管不伸入液面下,是为了防止倒吸
C. 加入过量乙酸,可使乙醇完全转化为乙酸乙酯
D. 实验完毕,可将乙酸乙酯从混合物中过滤出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com