
科目: 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是
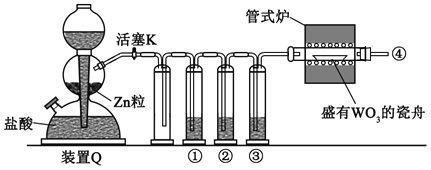
A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目: 来源: 题型:
【题目】氮、磷、砷、铁等元素及其化合物在现代农业、科技、国防建设中有着许多独特的用途。
(1)基态砷原子中核外电子占据最高能层的符号为_______,该能层的原子轨道数有_____ 个。下列有关表示基态氮原子的电子排布图中,仅违背洪特规则的是________(填字母)。
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
(2)氮的一种氢化物 N2H4 是一种良好的火箭发射燃料,传统制备肼的方法是:NaClO+2NH3=N2H4+NaCl+H2O,又知肼的熔点、沸点分别为1.4 ℃、113.5 ℃,氨气的熔点、沸点分别为-77.7 ℃、-33.5 ℃。
①N2H4中氮原子的杂化轨道类型为_______杂化。
②H2O的VSEPR模型为______。
③肼与氨气熔点、沸点差异最主要的原因是_________________。
(3)氨分子是一种常见配体,配离子[Co(NH3)6]3+中存在的化学键有___________ (填序号)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(4)已知[Co(NH3)6]3+的几何构型为正八面体形,推测[CoCl3(NH3)3]结构有__________种。

(5)LiFeAs可组成一种新型材料,其立方晶胞结构如图所示。若晶胞参数为 a nm,A、B 处的两个As原子之间距离=______nm,请在z轴方向投影图中画出铁原子的位置,用“ ”表示__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350mL 2molL﹣1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 molB. 0.25 molC. 0.3 molD. 0.35 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,氮氧化物进行治理已成为环境科学的重要课题。
(1)在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3-),其工作原理如图所示。
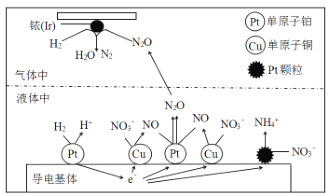
金属铱(Ir)表面发生了氧化还原反应,其还原产物的电子式是_____;若导电基体上的Pt颗粒增多,不利于降低溶液的含氮量,用电极反应式解释原因 _____________。
(2)在密闭容器中充入 10 mol CO和8 mol NO,发生反应 2NO(g)+2CO(g)![]() N2(g) +2CO2(g) H<0,如图为平衡时NO的体积分数与温度、压强的关系。
N2(g) +2CO2(g) H<0,如图为平衡时NO的体积分数与温度、压强的关系。
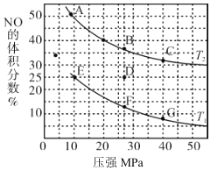
①该反应达到平衡后,为提高反应速率且同时提高转化率,可采取的措施有_______(填序号)。
a.改用高效催化剂 b.缩小容器的体积
c.升高温度 d.减小CO2的浓度
②压强为20 MPa、温度为T2下,若反应达到平衡状态时容器的体积为4 L,则此时CO2的浓度为_______。
③若在D点对反应容器升温的同时增大其体积至体系压强减小,重新达到的平衡状态可能是图中A ~G点中的_______点。
(3)研究表明,NOx的脱除率除与还原剂、催化剂相关外,还与催化剂表面氧缺位的密集程度成正比。以La0.8A0.2BCoO3+x(A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:NO(g)+□→NO(a) ΔH1 K1 2NO(a)→2N(a)+O2(g) ΔH2 K2
2N(a)→N2(g)+2□ ΔH3 K3 2NO(a)→N2(g)+2O(a) ΔH4 K4
2O(a)→O2(g)+2□ ΔH5 K5
注:“□”表示催化剂表面的氧缺位,“g”表示气态,“a”表示吸附态。
第一阶段用氢气还原B4+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是________________。第二阶段中各反应焓变间的关系:H2+H3=_____;该温度下,NO脱除反应2NO(g)![]() N2(g)+O2(g)的平衡常数K=____ (用含K1、K2、K3的表达式表示)。
N2(g)+O2(g)的平衡常数K=____ (用含K1、K2、K3的表达式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】以重晶石(BaSO4为主,含有钙等杂质)为原料,可按如下工艺生产碳酸钡:

温度为1173K~1473K时回转窑中发生的主要反应:C+O2![]() CO2,C+CO2
CO2,C+CO2![]() 2CO;BaSO4+4C
2CO;BaSO4+4C![]() BaS+4CO↑,BaSO4+2C
BaS+4CO↑,BaSO4+2C![]() BaS+2CO2↑。
BaS+2CO2↑。
(1)煤粉的主要作用是______________。
(2)若回转窑中通过量空气,则BaCO3产率________(填“降低”、“升高”、“不变”)。
(3)用 90~95℃的热水浸取BaS转化为可溶性化合物时无气体生成,此过程反应的化学方程式__________________。
(4)在回转窑产生的废气,其中________可以在碳化过程得到重新利用;硫化钡黑灰热水浸取,保温后热过滤除去的残渣也可在其他工业生产中再利用,如废渣中的 CaSO4可作 ____________(写一种即可)。
(5)为了得到纯净的BaCO3,省略的操作是_____________________。
(6)已知反应BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq),某同学利用该反应在实验室模拟BaSO4转化为BaCO3的过程:若每次加入1 L 2 mol/L的Na2CO3溶液,至少需要____次,可以将0.3 mol BaSO4完全转化为BaCO3。[Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=5×10-9]
BaCO3(s)+SO42-(aq),某同学利用该反应在实验室模拟BaSO4转化为BaCO3的过程:若每次加入1 L 2 mol/L的Na2CO3溶液,至少需要____次,可以将0.3 mol BaSO4完全转化为BaCO3。[Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=5×10-9]
查看答案和解析>>
科目: 来源: 题型:
【题目】正丁醛经催化加氢可制备1-丁醇。为提纯含少量正丁醛杂质的1-丁醇,现设计如下路线:
![]()
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃。则操作1~4分别是( )
A. 萃取、过滤、蒸馏、蒸馏 B. 过滤、分液、蒸馏、萃取
C. 过滤、蒸馏、过滤、蒸馏 D. 过滤、分液、过滤、蒸馏
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下列实验装置不能完成相应实验的是( )

A. 用装置①测量生成氧气的化学反应速率
B. 用装置②比较NaHCO3和Na2CO3的热稳定性
C. 装置③中分液漏斗内的液体可顺利加入蒸馏烧瓶
D. 装置④可实现制取CO2实验中的“即关即止,即开即用”的作用
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述正确的是( )
A. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
B. 32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
C. 标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
D. 39g钾与氧气完全反应,生成K2O转移NA个电子,生成KO2转移2NA电子
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl)晶体呈白色,见光分解,露置于潮湿空气中易被氧化。某研究小组设计如下两种方案在实验室制备氯化亚铜。
方案一:铜粉还原CuSO4溶液
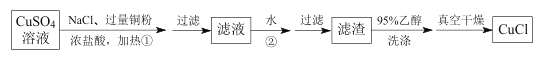
已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+2Cl-![]() [CuCl3] 2-(无色溶液)。
[CuCl3] 2-(无色溶液)。
(1)步骤①中发生反应的离子方程式为________________。
(2)步骤②中,加入大量水的作用是_____________ 。
(3)如图流程中用95%乙醇洗涤和真空干燥是为了防止________________ 。
方案二:在氯化氢气流中加热CuCl22H2O晶体制备,其流程和实验装置(夹持仪器略)如下:
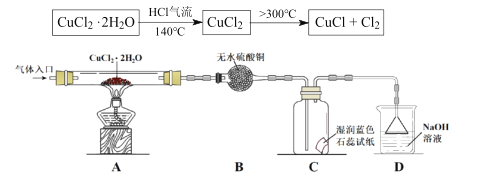
请回答下列问题:
(4)实验操作的先后顺序是 a→_____→______→_______→e (填操作的编号)
a.检査装置的气密性后加入药品 b.点燃酒精灯,加热
c.在“气体入口”处通入干燥HCl d.熄灭酒精灯,冷却
e.停止通入HCl,然后通入N2
(5)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是______。
(6)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2杂质,请分析产生CuCl2杂质的原因 ________________________。
(7)准确称取0. 2500 g氯化亚铜样品置于一定量的0.5 mol/L FeCl3溶液中,待样品完全溶解后,加水20 mL,用0. 1000 mol/L的Ce(SO4)2溶液滴定到终点,消耗24. 60 mLCe(SO4)2溶液。有关化学反应为Fe3++CuCl=Fe2++Cu2++Cl-、Ce4++Fe2+=Fe3++Ce3+,计算上述样品中CuCl的质量分数是_____________ %(答案保留4位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.Fe溶于足量稀HNO3:3Fe+8H++2![]() =3Fe2++2NO↑+4H2O
=3Fe2++2NO↑+4H2O
B.NaHCO3溶液与NaOH溶液反应:![]() +OH-=CO2↑+H2O
+OH-=CO2↑+H2O
C.向NaAlO2溶液中加入过量的稀HCl:![]() +H++H2O=Al(OH)3↓
+H++H2O=Al(OH)3↓
D.氨水和醋酸溶液混合:NH3H2O+CH3COOH=NH4++CH3COO-+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com