
科目: 来源: 题型:
【题目】海水中含有的氯化镁是镁的重要来源之一。从海水中制取镁有多种生产方法,可按如下步骤进行:
①把贝壳制成石灰乳
②在引入的海水中加石灰乳,沉降、过滤、洗涤沉淀物
③将沉淀物与盐酸反应,结晶、过滤、干燥产物
④将得到的产物熔融后电解
关于从海水中提取镁的下列说法不正确的是( )
A. 此法的优点之一是原料来源丰富
B. 进行①②③步骤的目的是从海水中提取氯化镁
C. 以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应
D. 第④步电解制镁是由于镁是很活泼的金属
查看答案和解析>>
科目: 来源: 题型:
【题目】NaCl是我们生活中必不可少的物质。将NaCl固体溶于水,溶解过程如图所示,下列说法正确的是
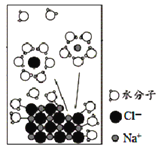
A.该过程发生了分解反应
B.离子从固体表面脱离后不会再回到固体表面
C.水合Na+的图示不科学
D.NaCl溶于水后发生了电离,是在通电条件下进行的
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组在Fe2+检验实验中观察到异常现象,为探究“红色褪去”的原因,进行如下实验:
编号 | 实验I | 实验II | 实验III |
实验步骤 |
| 将实验I褪色后的溶液分三份分别进行实验
| 为进一步探究“红色褪去”的原因,又进行以下实验 ① ②取反应后的溶液,滴加盐酸和BaCl2溶液 |
现象 | 溶液先变红,片刻后红色褪去,有气体生成(经检验为O2) | ①无明显现象 ②溶液变红 ③产生白色沉淀 | ①溶液变红,一段时间后不褪色。 ②无白色沉淀产生 |
分析上述三个实验,下列叙述不正确的是
A.在此实验条件下H2O2氧化Fe2+的速率比氧化SCN-的速率快
B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于SCN-被氧化
C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去只与H2O2的氧化性有关
D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理无关
查看答案和解析>>
科目: 来源: 题型:
【题目】1mol仅含C、H、O三种元素的有机物A在稀硫酸中水解生成1molB和1molC, B分子中N(C)∶N(H)=4∶5,135<Mr(B)<140;C与B分子中碳原子数相同,且Mr(B)=Mr(C)+2
(1)C的分子式为_____________________,
(2)B的分子具有高度对称性,苯环上的一氯取代物只有一种。B能与金属Na反应但不能与NaOH反应。写出B的结构简式_________________________;
(3)C有多种同分异构体,其中属于芳香族的酯类的同分异构体有_____________种;
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,取一定量冰醋酸,进行如下实验:
① 将冰醋酸配制成0.1 mol·L-1醋酸溶液;
② 取20 mL①所配溶液,加入a mL 0.1 mol·L-1 NaOH溶液,充分反应后,测得溶液pH=7;
③ 向②所得溶液中继续滴加稀盐酸,直至溶液中n(Na+) = n(Cl-)。
下列说法正确的是
A.①中:所得溶液的pH=1
B.②中:a=20
C.③中:所得溶液中c(CH3COO-)<c(H+),且pH<7
D.①与③所得溶液相比,等体积时所含CH3COOH分子数目相等
查看答案和解析>>
科目: 来源: 题型:
【题目】最近,科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是( )
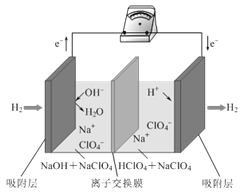
A.“全氢电池”工作时,将化学能转化为电能
B.电池的总反应是2H2+O2=2H2O
C.负极的电极反应是H2-2e-+2OH-=2H2O
D.电解质溶液中Na+向右移动,ClO4-向左移动
查看答案和解析>>
科目: 来源: 题型:
【题目】分子式为C3H7Br 的有机物甲在适宜的条件下能发生如下一系列转化:
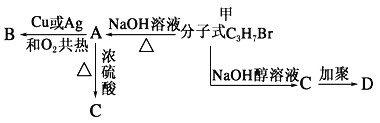
(1)若B能发生银镜反应,试回答下列问题:
①试确定有机物甲的结构简式:___________;
②用化学方程式表示下列转化过程:甲+ NaOH:___________________B+Ag(NH3)2OH:_________________
(2)若B不能发生银镜反应,请回答下列问题:
①试确定A的结构简式______________;
②用化学方程式表示下列转化过程:甲+NaOH![]() ____________________A→B:_____________________C→D:_____________________
____________________A→B:_____________________C→D:_____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列编号代表元素周期表中的一部分元素,用化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ⑥ | ⑦ | ⑧ | |||||
三 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
四 | ② | ④ |
(1)①、③、⑤的最高价氧化物的水化物碱性由强到弱顺序为___________(填化学式,下同)。
(2)②、③、④形成的简单阳离子半径由大到小的顺序是______________。
(3)⑨和⑩的最高价氧化物对应的水化物化学式为_______和_________。①在氧气中点燃生成淡黄色的固体,该固体的电子式为_______________,①能够与水剧烈反应,请写出该反应的化学方程式_______________,将元素⑩的单质通入NaBr溶液中,反应的离子方程式为_______________。
(4)⑥、⑦、⑧三种元素形成的气态氢化物的稳定性排序是____________(填化学式,下同),三种元素非金属性由强到弱的顺序为___________。
查看答案和解析>>
科目: 来源: 题型:
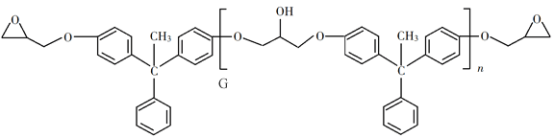
【题目】环氧树脂因其具有良好的机械性能、绝缘性能以及与各种材料的粘结性能,已广泛应用于涂料和胶黏剂等领域。下面是制备一种新型环氧树脂G的合成路线:
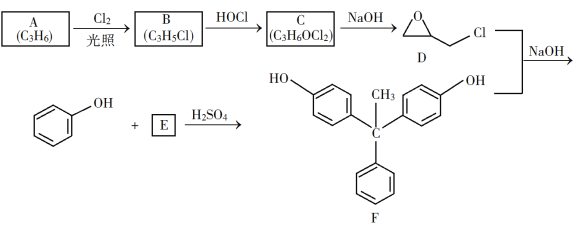
已知以下信息:
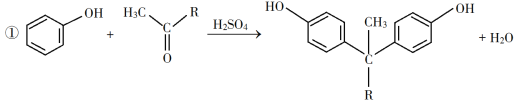

 回答下列问题:
回答下列问题:
(1)A是一种烯烃,化学名称为__________,C中官能团的名称为__________、__________。
(2)由B生成C的反应类型为__________。
(3)由C生成D的反应方程式为__________。
(4)E的结构简式为__________。
(5)E的二氯代物有多种同分异构体,请写出其中能同时满足以下条件的芳香化合物的结构简式__________、__________。
①能发生银镜反应;②核磁共振氢谱有三组峰,且峰面积比为3∶2∶1。
(6)假设化合物D、F和NaOH恰好完全反应生成1 mol单一聚合度的G,若生成的NaCl和H2O的总质量为765g,则G的n值理论上应等于__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制备溴苯可用如图所示的装置,填写下列空白:
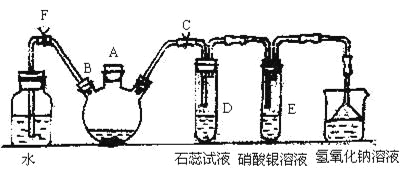
(1)关闭F夹,打开C夹,在装有少量苯的三口烧瓶中由A口加入少量溴,再加入少量铁屑,塞住A口,反应一段时间制的溴苯。溴苯是一种密度比水 (填”小”或”大”)的无色液体,在实验中因为 而显褐色。则三口烧瓶中发生反应的化学方程式为___ __和__ _。
(2)D、E试管内出现的现象为_____________________________________。
(3)待三口烧瓶中的反应进行到仍有气泡冒出时松开F夹,关闭C,可以看到的现象是__________________。
(4)三口烧瓶中的溴苯经过下列步骤分离提纯:
①向三口烧瓶中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是______________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是___。
(5)经过上述分离操作后,粗溴苯中还含有的主要杂质为_____________,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母):
A.重结晶 B.过滤 C.蒸馏 D.萃取
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com