
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)元素②的原子结构示意图为_____。
(2)元素③、④、⑤、⑥原子半径由大到小为_____。
(3)上述8种元素中,非金属性最强的是_____。
(4)元素②、③形成的气态氢化物稳定性:_____>_____;元素①、③、⑤可形成既含离子键又含极性共价键的化合物,写出其电子式:_____。
(5)元素⑦的最高价氧化物对应的水化物与元素⑤最高价氧化物对应的水化物溶液反应的离子方程式为_____。
(6)从原子结构的角度解释元素③和⑦的非金属性强弱:_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。
N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是____________________。
A.在单位时间内生成1mol CO2的同时消耗了1mol CO B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.混合气体的压强不再变化
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2 到t4 时刻正反应速率随时间的变化曲线:_____________

(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,1.2g 碳完全反应,吸收热量13.13kJ.
①该反应的热化学方程式为______________________________________________
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为___________________________________________________。(已知:H2S: ![]() ;
; ![]() ;H2CO3:
;H2CO3: ![]() ;
; ![]() )
)
(3)已知反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
CO | H2O | H2 | CO | 0 | ||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1条件下平衡常数K=______________(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是__________。
③该反应的△H ______0(填“<”或“>”);若在900℃时,另做一组实验,在此容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时v正___________v逆(填“<”,“>”,“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】次氯酸钾是―种白色粉末,极易溶于冷水,遇热水则分解,在空气中极不稳定,受热后迅速自行分解。工业上生产次氯酸押的流程如下:
![]()
下列说法正确的是
A. 步骤Ⅰ、Ⅱ发生的反应均为非氧化还原反应
B. 步骤Ⅱ采取的方法是加入足量水以制得Ca(OH)2溶液
C. 步骤Ⅲ氧化时,氯气是氧化剂,Ca(OH)2是还原剂
D. 步骤Ⅵ的操作包括蒸发浓缩,冷却结晶、在空气中晾干
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B为单质,C为化合物。能实现上述转化关系的是( )
A+B![]() C
C![]() C溶液
C溶液![]() A+B
A+B
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显血红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①②B.③④C.①③D.②④
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计了如下实验流程:在一个小烧杯里,加入20gBa(OH)2·8H2O晶体和10gNH4Cl晶体,然后将小烧杯放在事先已滴有3~4滴水的玻璃片上,并立即用玻璃棒迅速搅拌。实验流程示意图如图所示,回答下列问题:
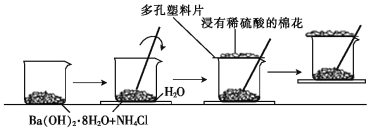
(1)实验中玻璃棒的作用是___________________。
(2)浸有稀硫酸的棉花的作用是___________________。
(3)请写出该反应的化学反应方程式:______________________________。
(4)通过______________________________现象,说明该反应为___________________(填“吸热”或“放热”)反应,这是因为反应物的总能量___________________(填“>”“<”或“=”)生成物的总能量。
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是同学们熟悉的物质:
①O2②H2O2③MgCl2④H2SO4⑤Na2CO3⑥NH4Cl⑦CO2⑧Ne⑨Na2O2⑩NaOH
(1)这些物质中,属于共价化合物的是________(填序号,下同);只含有离子键的是________;不含化学键的是________。
(2)写出下列物质的结构式:
①O2________;②H2O2_______。
(3)写出下列物质的电子式
⑨Na2O2__________;⑦CO2__________;⑥NH4Cl____________。
(4)用电子式表示③MgCl2的形成过程:________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的转化在给定条件下均能通过一步反应实现的是
A. NaAlO2(aq)![]() AlCl3
AlCl3![]() Al2O3
Al2O3
B. N2![]() NO2
NO2![]() HNO3
HNO3
C. NaCl(饱和)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
D. FeS2![]() SO3
SO3![]() H2SO4
H2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的是
A. 标准状况下,2.24L苯含C-H键的数H为0.6NA
B. 5.6gFe与过量稀硝酸反应,转移的电子数为0.3NA
C. K35ClO3与浓H37Cl反应制得7.1g氯气,则生成的Cl2分子数为0.1NA
D. 6.4gCu与40 mL10mol/L浓硝酸充分反应,生成的NO2分子数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是
A. SO2是直线形分子B. SO3是三角锥形分子
C. BF3的键角为120°D. PCl3是平面三角形分子
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示)。

下列有关说法正确的是( )
A.大量的氮、磷废水排入海洋,易引发赤潮
B.在③中加入盐酸溶解得到MgCl2溶液,再直接蒸发得到MgCl2·6H2O
C.在④⑤⑥中溴元素均被氧化
D.在①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com