
科目: 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)是一种金属腐蚀抑制剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如下图所示。
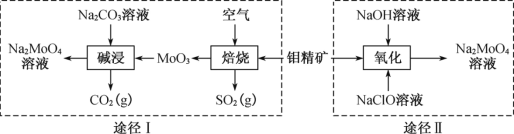
(1)途径Ⅰ碱浸时发生反应的化学方程式为_________________________。
(2)途径Ⅱ氧化时还有Na2SO4生成,则反应的离子方程式为___________________________。
(3)已知途径Ⅰ的钼酸钠溶液中c(MoO42-)=0.40mol·L-1,c(CO32-)=0.10mol·L-1。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是___[已知Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]。
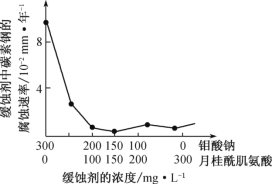
(4)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图。
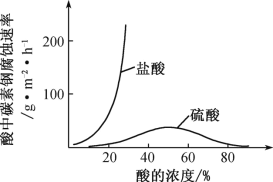
①当硫酸的浓度大于90%时,碳素钢腐蚀速率几乎为零,原因是_____________________。
②若缓释剂钼酸钠-月桂酸肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠(M=206g·mol-1)的物质的量浓度为_____(计算结果保留3位有效数字)。
(5)二硫化钼用作电池的正极材料时接受Li+的嵌入,锂和二硫化钼形成的二次电池的总反应为xLi+nMoS2 Lix(MoS2)n,则电池放电时正极的电极反应是_________。
Lix(MoS2)n,则电池放电时正极的电极反应是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在1L的容器中,用纯净的CaCO3与100mL稀盐酸反应制取CO2,反应生成CO2的体积随时间的变化关系如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是( )
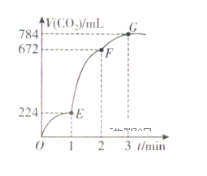
A.OE段表示的平均反应速率最快
B.F点收集到的CO2的量最多
C.EF段,用盐酸表示该反应的平均反应速率为0.4mol·L-1·min-1
D.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素X、Y、Z、Q、R的原子序数依次增大,X的简单阴离子与锂离子具有相同的电子层结构,Y原子最外层电子数等于内层电子数的2倍,Q的单质与稀硫酸剧烈反应生成X的单质。向100mLX2R的水溶液中缓缓通入RZ2气体,溶液pH与RZ2体积关系如下图。下列说法正确的是

A.X2R溶液的浓度为0.03mol·L-1
B.工业上通常采用电解法冶炼Q的单质
C.最简单气态氢化物的稳定性:Y>Z>R
D.RZ2通入BaCl2、Ba(NO3)2溶液中,均无明显现象
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH)。下列说法正确的是
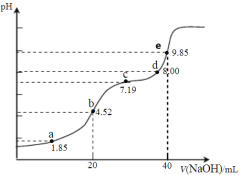
A.b点所得溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
B.a点所得溶液中:2c(HSO3-)+c(SO32-)=0.1mol·L-1
C.e点所得溶液中:c(Na+)> c(SO32-)> c(H+)> c(OH-)
D.c点所得溶液中:c(Na+)>3c(HSO3-)
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D均含有同一种元素,它们之间的转化关系如图所示(反应条件及其他物质已经略去) A ![]() B
B ![]() C
C ![]() D
D
I、若A是一种黄色固体单质;B为酸雨的成因之一,且可使品红溶液褪色,回答以下问题:
(1)将B通入KMnO4溶液的现象为:_____;体现B的____(选填“氧化性”“还原性”“漂白性”);
(2)请写出D的浓溶液与单质铜反应的化学方程式:_____.
Ⅱ、若A气体可使湿润的红色石蕊试纸变蓝,则回答下列问题
(1)写出A→B的化学反应方程式_________
(2)实验室常用图所示装置制取并收集A气体,请在框中画出实验室收集A气体的装置图_____
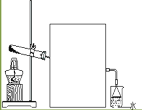
(3)尾气处理装置中使用倒扣漏斗的作用是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭系统中有反应C(s)+CO2(g) ![]() 2CO(g),能使反应速率加快的措施是
2CO(g),能使反应速率加快的措施是
①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎 ④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2使得压强增大
A. ①②③⑥B. ①②④⑥C. ①②③④D. ①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲的一种工艺流程如图:(已知TeO2微溶于水,易溶于强酸和强碱)下列有关说法正确的是

A.“氧化浸出”时为使碲元素沉淀充分,应加入过量的硫酸
B.“过滤”用到的玻璃仪器:分液漏斗、烧杯、玻璃棒
C.判断粗碲洗净的方法:取少量最后一次洗涤液,加入BaCl2溶液,没有白色沉淀生成
D.“还原”时发生的离子方程式为2SO32-+Te4++4OH-=Te↓+2SO42-+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】微型化学实验能有效减少污染,节约药品。下图中,某学生在衬有一张白纸的玻璃片上放置表面皿,在表面皿上的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,在表面皿中心处放置2小粒KMnO4晶体,并滴加一滴浓盐酸,立即将表面皿盖好。可见KMnO4晶体很快溶解,并产生气体。

(1) 完成本实验中制取Cl2的化学方程式:
__KMnO4+____HCl(浓)—___KCl +_____ MnCl2 + ____ Cl2↑+__ ______ .
如该反应中消耗还原剂的物质的量为8mol,则电子转移数目为________ .
⑵b处的实验现象为___________;c处的实验现象为____________
⑶d处反应的离子方程式为_______、_______
⑷通过该实验能比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱,其氧化性由强到弱的顺序是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于化学能与其他能量相互转化的说法正确的是( )
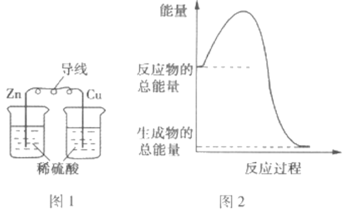
A.图1所示的装置能将化学能转变为电能
B.图2所示的反应为吸热反应
C.中和反应中,反应物的总能量比生成物的总能量低
D.化学反应中能量变化的根本原因是化学键的断裂与生成
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用浓硫酸配制1.0mol/L硫酸溶液480mL,回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 ______(填字母),配制上述溶液还需用到的玻璃仪器是_________(填仪器名称)。
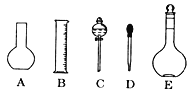
(2)容量瓶上标有以下5项中的_____(填序号)
①压强 ②温度 ③容量 ④浓度 ⑤刻度线
(3)在配制过程中,下列操作使所配溶液浓度偏大的是__________ .
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
②定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
③定容时,仰视刻度线
④使用容量瓶前用蒸馏水洗涤且没干燥
(4)计算实验室配制上述溶液需用量筒量取质量分数为98%、密度为1.84g/mL的浓硫酸的体积为:_____mL。(保留小数点后一位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com