
科目: 来源: 题型:
【题目】合成氨对人类生存具有重大意义,反应为:N2(g)+3H2(g)![]() 2NH3(g)△H
2NH3(g)△H
(1)科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。

①NH3的电子式是___。
②决定反应速率的一步是___(填字母a、b、c、…)。
③由图象可知合成氨反应的△H____0(填“>”、“<”或“=”)。
(2)传统合成氨工艺是将N2和H2在高温、高压条件下发生反应。若向容积为1.0L的反应容器中投入5molN2、15molH2,在不同温度下分别达平衡时,混合气中NH3的质量分数随压强变化的曲线如图所示:

①温度T1、T2、T3大小关系是___。
②M点的平衡常数K=____(可用分数表示)。
(3)目前科学家利用生物燃料电池原理(电池工作时MV2+/MV+在电极与酶之间传递电子),研究室温下合成氨并取得初步成果,示意图如图:

①导线中电子移动方向是____。
②固氮酶区域发生反应的离子方程式是___。
③相比传统工业合成氨,该方法的优点有___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4·7H2O)
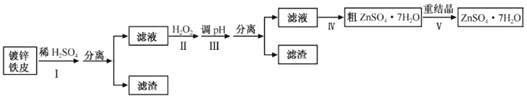
相关信息如下:
①金属离子形成氢氧化物沉淀的相关pH范围。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Zn2+ | 5.4 | 8.2 |
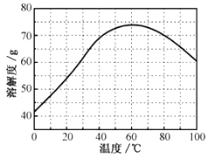
②ZnSO4的溶解度(物质在100g水中溶解的质量)随温度变化曲线。请回答:
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是__。
②步骤Ⅰ可用于判断镀锌层完全反应的实验现象是__。
(2)步骤Ⅱ须加入过量H2O2理由是__。
(3)步骤Ⅲ,合适的pH范围是__。
(4)步骤Ⅳ,需要用到下列所有操作:a.蒸发至溶液出现晶膜,停止加热;b.在60℃蒸发溶剂;c.冷却至室温;d.在100℃蒸发溶剂;e.过滤。
请给出上述操作的正确顺序__。(操作可重复使用)
(5)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO47H2O晶体颗粒大小分布如图所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择__方式进行冷却结晶。
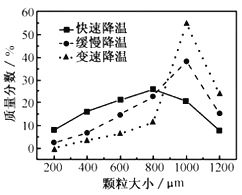
A.快速降温 B.缓慢降温 C.变速降温
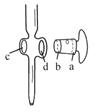
(6)①ZnSO47H2O产品的纯度可用配位滴定法测定。
下列关于滴定分析,正确的是__。
A.图中,应将凡士林涂在旋塞的a端和旋塞套内的c端
B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得的体积比实际消耗的小
②图中滴定终点是的读数是___mL。

查看答案和解析>>
科目: 来源: 题型:
【题目】双氧水在医疗、军事和工业上用途广泛,工业上合成双氧水的方法有多种,其中一种合成工艺为乙基蒽醌(EAQ)法。
已知:
①反应原理为

②工业制备流程如图所示。

③制备过程中,将EAQ溶于有机溶剂中配制成工作液。
请回答下列问题:
(1)该流程中,循环使用的原料为___。
(2)现有甲、乙、丙三种有机溶剂,相关物质的溶解情况如表所示,则配制工作液时,应选用有机溶剂__(填“甲”“乙”或“丙”),原因为___。
物质 | 甲 | 乙 | 丙 |
EAQ | 互溶 | 不溶 | 互溶 |
EHAQ | 互溶 | 不溶 | 互溶 |
H2O2 | 不溶 | 不溶 | 互溶 |
H2O | 不溶 | 不溶 | 互溶 |
(3)“氧化”时,控制温度为45~55℃,原因为___。
(4)“萃取”时,所选用的萃取剂是一种常见的溶剂,其化学名称为__,选用该溶剂作为萃取剂的原因为__。
(5)“净化”的目的是将萃取液中的过氧化氢分离出来,则应选用的分离方法为___。
(6)采用电解法制备双氧水的装置示意图如图所示,通入空气的电极的电极反应式___。
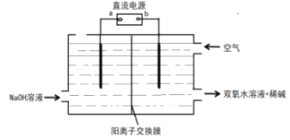
查看答案和解析>>
科目: 来源: 题型:
【题目】H2S为二元弱酸。20℃时,向0.100mol·L-1的Na2S溶液中缓慢通入HCl气体(忽略溶液体积的变化及H2S的挥发)。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
A.c(Cl-)=0.100mol·L-1的溶液中:c(OH-)-c(H+)=c(H2S)-2c(S2-)
B.通入HCl气体之前:c(S2-)>c(HS-)>c(OH-)>c(H+)
C.c(HS-)=c(S2-)的碱性溶液中:c(Cl-)+c(HS-)>0.100mol·L-1+c(H2S)
D.pH=7的溶液中:c(Cl-)=c(HS-)+2c(H2S)
查看答案和解析>>
科目: 来源: 题型:
【题目】有关物质结构、性质的说法中正确的是( )

①烃的密度比水的密度小
②C2H6、C4H10、C6H14在常温下均为气体
③1 mol苯最多与3 mol H2发生加成反应,是因为苯分子含有3个碳碳双键
④水芹烯(桂皮中的一种成分)键线式如图,其分子式为C10H16
⑤![]() 互为同系物
互为同系物
⑥甲烷与氯气在光照的条件下可以制取纯净的一氯甲烷
⑦C5H12有三种同分异构体
A. ①②⑤ B. ③④⑦ C. ③⑤⑥ D. ①④⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,正确的是
A. 甲苯可以与液溴混合后加入铁粉生成![]()
B. 实验室制备乙烯时,温度计水银球应该插入浓硫酸和无水乙醇的混合液液面以下
C. 向溴乙烷中加入NaOH溶液加热,充分反应,再加入AgNO3溶液,产生淡黄色沉淀,证明溴乙烷中含有溴元素
D. 制备新制Cu(OH)2悬浊液时,将4~6滴2%的NaOH溶液滴入2mL2%的CuSO4溶液中,边滴边振荡
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇分子中不同的化学键如右图,关于其在各类反应中断裂键的说明不正确的是

A. 和金属钠反应键①断裂
B. 和HBr在一定条件下反应时键②断裂
C. 和浓硫酸共热140℃时键①或键②断裂;170℃时键②③断裂
D. 在Ag催化下和O2反应键①③断裂
查看答案和解析>>
科目: 来源: 题型:
【题目】在可逆反应2A(g)+3B(g)![]() xC(g)+D(g)中,已知:反应开始加入的物质只有 A、B,起始浓度 A 为 5 mol·L-1,B 为 3 mol·L-1,前 2 min C 的平均反应速率为 0.5 mol·L-1·min-1,2 min 后,测得 D 的浓度为 0.5mol·L-1,则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有 A、B,起始浓度 A 为 5 mol·L-1,B 为 3 mol·L-1,前 2 min C 的平均反应速率为 0.5 mol·L-1·min-1,2 min 后,测得 D 的浓度为 0.5mol·L-1,则关于此反应的下列说法中正确的是( )
A.2 min 末时 A 和 B 的浓度之比为 5∶3
B.x=1
C.2 min 末时 A 消耗的浓度为 0.5 mol·L-1
D.2 min 末时 B 的浓度为 1.5 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2 ![]() 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
A. 1.6 mol B. 2.8 mol
C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】HIO3是强酸,其水溶液是强氧化剂。工业上,以KIO3为原料可制备HIO3。某学习小组拟用如图装置制备碘酸。M、N为惰性电极,ab、cd为交换膜。下列推断错误的是( )
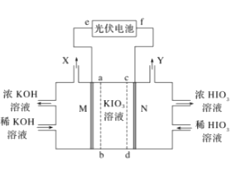
A.光伏电池的e极为负极,M极发生还原反应
B.在标准状况下收集6720mLX和Y的混合气体时KIO3溶液减少3.6g
C.Y极的电极反应式为2H2O-4e-═O2↑+4H+
D.制备过程中要控制电压,避免生成HIO4等杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com