
科目: 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关W、X、Y、Z、R五种元素的叙述正确的是( )

A. 常温下,Z的单质为气态物质
B. Y、Z的阴离子的电子层结构都与R原子的相同
C. W的氢化物的稳定性要比X的强
D. Y的元素的非金属性比W元素强
查看答案和解析>>
科目: 来源: 题型:
【题目】1912年的诺贝尔化学奖授予法国化学家V.Grignard,用于表彰他所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成中的巨大贡献。Grignard试剂的合成方法是:RX+Mg ![]() RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)乙醚发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)乙醚发生反应,再水解就能合成各种指定结构的醇:
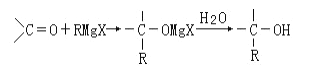
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下:
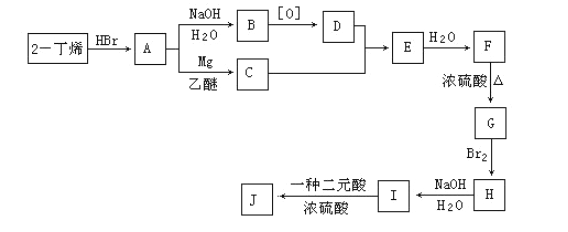
请按要求填空:
(1) 3,4-二甲基-3-己醇是: ____(填代号),E的结构简式是 ___;
(2)C→E的反应类型是 _____,H→I的反应类型是 ____;
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B ___ , I→J _____ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应:PCl5(g)![]() PCl3(g)+Cl2(g) ΔH=a kJ·mol-1(a>0)。0~10 min保持容器温度不变,10 min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。
PCl3(g)+Cl2(g) ΔH=a kJ·mol-1(a>0)。0~10 min保持容器温度不变,10 min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。
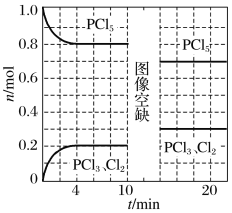
下列说法正确的是
A.0~4 min的平均速率v(PCl3)=0.025 mol·L-1·min-1
B.10 min时改变的条件是增加了一定量的PCl5
C.若起始时向该容器中充入2.0 mol PCl3和2.0 mol Cl2,保持温度为T,反应达平衡时放出的热量小于1.6a kJ
D.温度为T,起始时向该容器中充入1.0 mol PCl5、0.10 mol PCl3和0.10 mol Cl2,反应达到平衡前v正<v逆
查看答案和解析>>
科目: 来源: 题型:
【题目】目前比较热门的Al-H2O2电池,其电池总反应为2Al+![]() =
=![]() +OH-+H2O。现以AlH2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法正确的是
+OH-+H2O。现以AlH2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法正确的是
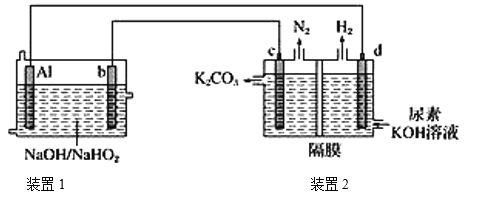
A.装置1中Na+移向电极b,装置2中的隔膜可以换成质子交换膜
B.电极c的电极反应式:CO(NH2)2-6e-+8OH-=CO32-+N2↑+6H2O
C.电解时,电流的流动路径:Al极→导线→d极→电解质溶液→c极→导线→b极
D.通电5 min后,若Al电极的质量减轻5.4g,则产生H2的体积为4.48L(标准状况)
查看答案和解析>>
科目: 来源: 题型:
【题目】A+、B2-、C-、D、E、F3+分别表示含10个电子的六种粒子(离子或分子)。其中:
a.A+、B2-、F3+核外电子层结构相同
b.C-是由两种元素组成的
c.D是两种元素组成的四原子分子
d.E在常温下是无色液体
e.往含F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(1)C-的电子式___。
(2)A+、B2-、F3+离子半径由大到小的顺序为___(用离子符号表示)。
(3)含F3+的溶液中通入过量D,反应的离子方程式是___。
(4)A单质与E反应的离子方程式为___,生成的化合物中化学键的类型是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的方程式正确的是
A.电解氯化镁溶液:2Cl–+2H2O![]() H2↑+Cl2↑+2OH–
H2↑+Cl2↑+2OH–
B.碳酸氢铵溶液中加入足量石灰水:Ca2++![]() +OH–=CaCO3↓+H2O
+OH–=CaCO3↓+H2O
C.Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.氢氧化钡溶液中加入稀硫酸:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】工业中很多重要的化工原料都来源于石油化工,如图中的苯、丙烯、有机物A等,其中A的产量可以用来衡量一个国家的石油化工发展水平。请回答下列问题:
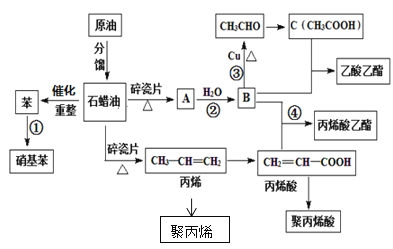
(1)A的结构简式为__,丙烯酸中官能团的名称为___。
(2)写出下列反应的反应类型①__,③___。
(3)用一种方法鉴别B和C,所用试剂是__。
(4)写出下列反应方程式:
丙烯→聚丙烯__;
丙烯酸+B→丙烯酸乙酯__。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可以从牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45 倍。 | (1)A的相对分子质量为:_____________。 |
(2)将9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为:______________。 |
(3)另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。 | (3)用结构简式表示A 中含有的官能团__________。 |
(4)A的核做共振氢谱如下图:
| (4)A中含有四种氢原子。 |
(5)综上所述,A 的结构简式为__________, 写出两分子A能脱去两分子水形成一种六元环状化合物的化学方程式_______________________________________ (6)A有多种同分异构体,其中一种能发生银镜反应,1mol该种同分异构体与足量的金属钠反应产生1molH2,则该种同分异构体的结构简式为 ____________。 | |
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现黑色和红色交替的现象,请写出相应的化学方程式______________________________、________________________________。
(2)甲水浴的作用是_________________________________________;乙水浴的作用是_________________________________________。
(3)反应进行一段时间后,干试管a中能收集到不同的物质,它们是________。集气瓶中收集到的气体的主要成分是________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有______。要除去该物质,可在混合液中加入____________(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
查看答案和解析>>
科目: 来源: 题型:
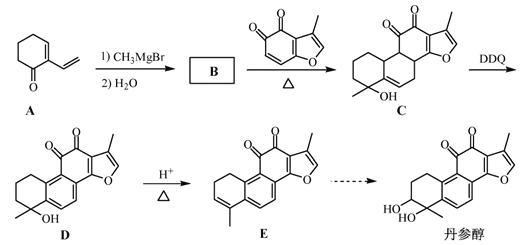
【题目】丹参醇是存在于中药丹参中的一种天然产物。合成丹参醇的部分路线如下:
已知: 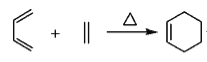
(1)C中的含氧官能团名称为羟基、_____和______。
(2)D![]() E的反应类型为__________________。
E的反应类型为__________________。
(3)B的分子式为C9H14O,写出B的结构简式:__________________。
(4)写出以![]() 和
和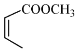 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)________________。
的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com