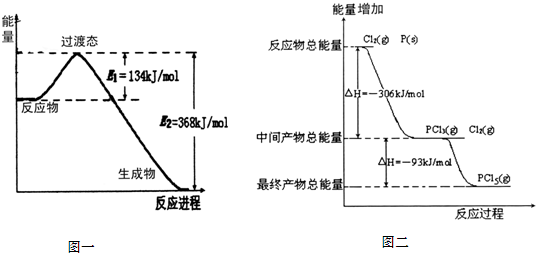
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.分析图(本题最下方)中信息,回答下列问题:
(1)图一是NO
2和CO反应生成CO
2和NO过程中能量变化示意图,请写出NO
2和CO反应的热化学方程式:
NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234KJ/mol
NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234KJ/mol
.在反应体系中加入催化剂,E
1和E
2的变化是:E
1减小
减小
,E
2减小
减小
(填“增大”、“减小”或“不变”),对反应热是否有影响?
不变
不变
,原因是
加入催化剂,改变反应的途径,降低反应所需的活化能
加入催化剂,改变反应的途径,降低反应所需的活化能
.
(2)图二是红磷P(s)和Cl
2(g)发生反应生成PCl
3(g)和PCl
5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据).根据图二回答下列问题:
①P(s)和Cl
2(g)反应生成PCl
3(g)的热化学方程式
P(s)+Cl2(g)═PCl3(g)△H=-306KJ/mol
P(s)+Cl2(g)═PCl3(g)△H=-306KJ/mol
.
PCl
5(g)分解成PCl
3(g)和Cl
2(g)的热化学方程式
PCl5(g)═PCl3(g)+Cl2(g)△H=+93KJ/mol
PCl5(g)═PCl3(g)+Cl2(g)△H=+93KJ/mol
.
②P(s)和Cl
2(g)分两步反应生成1molPCl
5(g)的△H
1与P(s)和Cl
2(g)一步反应生成1molPCl
5(g)的△H
2关系是:△H
2等于
等于
△H
1(填“大于”、“小于”或“等于”),原因是
反应中的能量变化只与起态、终态有关,与反应的途径无关
反应中的能量变化只与起态、终态有关,与反应的途径无关
.


 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: C(g)+D(g)
C(g)+D(g)