
科目: 来源: 题型:
【题目】某氨气燃料电池,如图所示,下列说法不正确的是
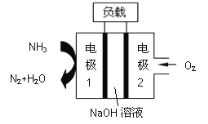
A.正极的电极反应式为O2+4e-+4H+=2H2O
B.电子流向:电极1→负载→电极2
C.Na+由左向右移动
D.NH3在电极1上发生氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用Ca与H2反应制取氢化钙(CaH2)。下列实验装置和原理不能达到实验目的的是( )

A. 装置甲制取H2B. 装置乙净化干燥H2
C. 装置丙制取CaH2D. 装置丁吸收尾气
查看答案和解析>>
科目: 来源: 题型:
【题目】下列方程式不正确的是
A.NaHCO3在水中的电离方程式:NaHCO3 = Na++HCO![]()
B.氯化镁溶液与氨水反应的离子方程式:Mg2++2OH-= Mg(OH)2↓
C.Cl2与水反应的离子方程式:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
D.醋酸钠水解的离子方程式CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示。下列说法正确的是
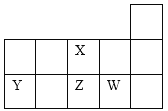
A.Y、Z、X三种元素的原子半径依次增大
B.X、Z都是第二周期ⅥA族元素,单质的氧化性X>Z
C.Y的气态氢化物的热稳定性比Z的高
D.W元素最高价氧化物的水化物的酸性比Z的强
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.为了探究一种固体化合物甲(仅含3种元素)的组成和性质,设计并完成如下实验:(气体体积已经换算成标准状况下的体积)
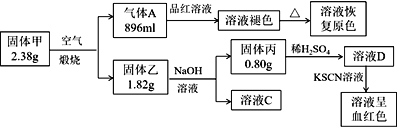
请回答:
(1)写出化合物甲的化学式________。
(2)写出形成溶液C的化学方程式:_____________。
(3)写出气体A通入溶液D中,发生反应的离子反应方程式__________。
Ⅱ.近年来化学家又研究开发出了用 H2和CH3COOH 为原料合成乙醇(反应Ⅰ),同时会发生副反应Ⅱ。
反应Ⅰ.CH3COOH(g)+2H2(g)![]() CH3CH2OH(g) +H2O(g) △H1
CH3CH2OH(g) +H2O(g) △H1
反应Ⅱ. CH3COOH(g)+H2(g)![]() CO(g)+CH4(g)+H2O(g) △H2>0
CO(g)+CH4(g)+H2O(g) △H2>0
已知:乙醇选择性是转化的乙酸中生成乙醇的百分比。请回答:
(1)反应Ⅰ一定条件下能自发进行,则△H1 ___0。(填“>”或“<”)
(2)某实验中控制 CH3COOH 和 H2 初始投料比为 1∶1.5,在相同压强下,经过相同反应时间测得如下实验数据:
温度(K) | 催化剂 | 乙酸的转化率(%) | 乙醇选择性(%) |
573 | 甲 | 40 | 50 |
573 | 乙 | 30 | 60 |
673 | 甲 | 55 | 35 |
673 | 乙 | 40 | 50 |
①有利于提高CH3COOH转化为CH3 CH2OH平衡转化率的措施有______。
A 使用催化剂甲 B 使用催化剂乙
C 降低反应温度 D 投料比不变,增加反应物的浓度
E 增大CH3COOH和H2的初始投料比
②673K甲催化剂作用下反应Ⅰ已达平衡状态,测得乙酸的转化率为50%,乙醇的选择性40%,若此时容器体积为 1.0L,CH3COOH 初始加入量为2.0mol,则反应Ⅰ的平衡常数 K= _____。
③表中实验数据表明,在相同温度下不同的催化剂对CH3COOH转化成CH3CH2OH的选择性有显著的影响,其原因是_________________。
(3)在图中分别画出I在催化剂甲和催化剂乙两种情况下“反应过程-能量”示意图。_____

查看答案和解析>>
科目: 来源: 题型:
【题目】药物中间体(G)在有机制药工业中的一种合成方法如下:
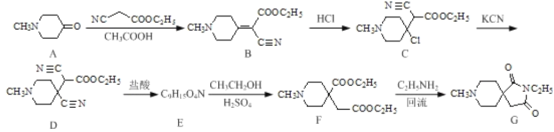
回答下列问题:
(1)化合物D和G中含氧官能团的名称分别为___________、_________。
(2)由B→C的反应类型为_____ ;写出C→ D反应的化学方程式:________。
(3)化合物E的结构简式为________。
(4)反应F→G的另一种生成物是___________。
(5)写出同时满足下列条件的B的同分异构体的结构简式:_______。
①能与新制Cu(OH)2加热条件下反应生成砖红色沉淀,水解产物之一能与FeCl3溶液发生显色反应:
②核磁共振氢谱为四组峰,峰面积比为1:2:4:9;
③分子中含有氨基。
(6)已知:RCN![]() RCH2NH2请设计以HOOCCH2COOH和CH3CH2Cl为原料制备
RCH2NH2请设计以HOOCCH2COOH和CH3CH2Cl为原料制备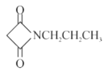 的合成路线:_________(无机试剂任用)。
的合成路线:_________(无机试剂任用)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铂、钴、镍及其化合物在工业和医药等领域有重要应用。回答下列问题:
(1)筑波材料科学国家实验室科研小组发现了在5K下呈现超导性的晶体CoO2,该晶体具有层状结构。
①晶体中原子Co与O的配位数之比为_________。
②基态钴原子的价电子排布图为_______。
(2)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于_____晶体;写出两种与CO具有相同空间构型和键合形式的分子或离子:_______。
(3)某镍配合物结构如图所示:
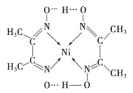
①分子内含有的化学键有___________(填序号).
A 氢键 B 离子键 C 共价键 D 金属键 E 配位键
②配合物中C、N、O三种元素原子的第一电离能由大到小的顺序是N> O>C,试从原子结构解释为什么同周期元素原子的第一电离能N>O_________。
(4)某研究小组将平面型的铂配合物分子进行层状堆砌,使每个分子中的铂原子在某一方向上排列成行,构成能导电的“分子金属" ,其结构如图所示。
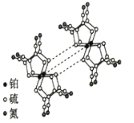
①"分子金属"可以导电,是因为______能沿着其中的金属原子链流动。
②"分子金属"中,铂原子是否以sp3的方式杂化?_________(填“是"或“否"),其理由是__________。
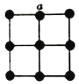
(5)金属铂晶体中,铂原子的配位数为12,其立方晶胞沿x、y或z轴的投影图如图所示,若金属铂的密度为d g·cm-3,则晶胞参数a=_______nm(列计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与D反应生成相对分子质量为100的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)写出A与溴的四氯化碳溶液反应的化学方程式__________
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称"同系物"),它们均符合通式CnH2n+2。当n=______时,这类有机物开始出现同分异构体。
(3)B具有的性质是__________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式__________
(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为____;其化学方程式为__________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Cl2与H2O的反应:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 铜丝插入Fe2(SO4)3溶液中:Cu +Fe3+ =Cu2+ +Fe2+
C. 向FeBr2溶液中通入过量Cl2:2Br-+Cl2=Br2+2Cl-
D. 向Na2SiO3溶液中通入过量CO2:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3—
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车排放的尾气为大气污染物之一,目前,可利用以下化学原理处理汽车尾气:2NO+2CO![]() 2CO2+N2。
2CO2+N2。
(1)写出CO2的结构式____________。
(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示:

则反应速率v(a)、v(b)、v(c)的大小关系是_______。
(3)为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
(资料查阅)A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响。
(实验设计)课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验:
实验编号 | 实验目的 | T/℃ | NO初始浓度/(mol/L) | CO初始浓度/(mol/L) | 同种催化剂的比表面积/(m2/g) | c(CO)不变时所用的时间/min |
Ⅰ | 参照实验 | 280 | 6.50×10-5 | 4.00×10-3 | 80 | t |
Ⅱ | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
Ⅲ | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
(结论)
① 实验编号Ⅱ的实验目的为______________。
② 课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是_______, 且______反应速率将_______(填“增大”“减小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com