
科目: 来源: 题型:
【题目】下列说法正确的是
A.C60、C70、碳纳米管互为同素异形体B.H、D、T互为同位素,中子数都为1
C.C4H10O与C2H6O一定互为同系物D.C4H10的一氯代物只有两种
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。回答下列问题:
①NiO、FeO的晶体结构类型均与NaCl的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点:FeO____(填“<”或“>”)NiO。
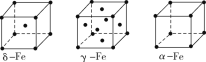
②铁有δ、γ、α三种同素异形体,各晶胞结构如图所示,则δ、α两种晶胞中铁原子的配位数之比为____。
(2)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数目之比为__;该晶体中,原子之间的相互作用是____。
(3)某钙钛型复合氧化物如图所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。
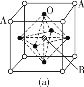
①用A、B、O表示这类特殊晶体的化学式:____。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价,导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为____。
③下列有关说法正确的是____。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧元素的第一电离能比氮元素的第一电离能大
C.锰的电负性为1.59,铬的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图(b)所示
查看答案和解析>>
科目: 来源: 题型:
【题目】NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为:__________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
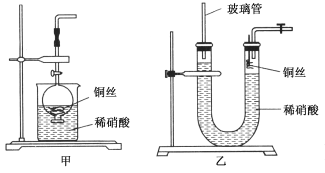
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
A.铁B.铝C.铂D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是____________________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。长玻璃管的作用是______________________________________________。
(4)以下收集NO气体的装置,合理的是________(填选项代号)。

(5)假设实验中12.8gCu全部溶解,需要通入标况下________LO2才能使NO全部溶于水。
(6)用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”、“乙”、“丙”或“丁”),理由是____________________________。
甲:铜+浓硝酸→硝酸铜
乙:铜+稀硝酸→硝酸铜
丙:铜+氯气→氯化铜;氯化铜+硝酸→硝酸铜
丁:铜+空气→氧化铜;氧化铜+硝酸→硝酸铜
查看答案和解析>>
科目: 来源: 题型:
【题目】根据反应KMnO4+FeSO4+H2SO4→MnSO4+Fe2(SO4)3+K2SO4+H2O(未配平)设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。下列说法不正确的是( )

A. 石墨b是原电池的负极,发生氧化反应
B. 甲烧杯中的电极反应式:MnO4-+5e-+8H+===Mn2++4H2O
C. 电池工作时,盐桥中的阴阳离子分别向乙甲烧杯中移动,保持溶液中的电荷平衡
D. 忽略溶液体积变化,Fe2(SO4)3浓度变为1.5 mol/L,则反应中转移的电子为0.1 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】安徽省具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题,
(1)请写出基态Cu原子的外围电子排布式 ____________ 。焰火中的绿色是铜的焰色,基态铜原子在灼烧时外围电子发生了 _________ 而变为激发态。
(2)新型农药松脂酸铜具有低残留的特点,下图是松脂酸铜的结构简式
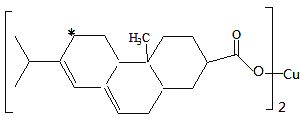
请分析1个松脂酸铜中π键的个数_____ ;加 “*”碳原子的杂化方式为 ______ 。
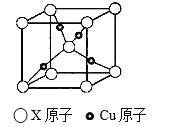
(3)下图是某铜矿的晶胞图,请推算出此晶胞的化学式(以X表示某元素符号)______________ ;与X等距离且最近的X原子个数为____
(4)黄铜矿在冶炼的时候会产生副产品SO2,SO2分子的几何构型______,比较第一电离能:S _____ O(填“>”或“<”)
(5)黄铜合金可以表示为Cu3Zn,为面心立方晶胞,晶体密度为8.5g/cm3,求晶胞的边长(只写计算式,不求结果)____________ nm。
查看答案和解析>>
科目: 来源: 题型:
【题目】能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的外围电子排布式_____,它位于周期表____区.
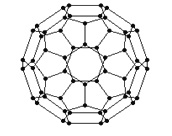
(2)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途.富勒烯(C60)的结构如图,分子中碳原子轨道的杂化类型为________________;1mol C60分子中σ键的数目为____________个.
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓(GaAs)、硫化镉(CdS)薄膜电池等.
①第一电离能:As____Ga(填“>”、“<”或“=”).
②SeO2分子的空间构型为_____.
(4)三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在太阳能电池制造中得到广泛应用.它可在铜的催化作用下由F2和过量的NH3反应得到,该反应中NH3的沸点____(填“>”、“<”或“=”)HF的沸点,NH4F固体属于____晶体.往硫酸铜溶液中加入过量氨水,可生成配离子.已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是______.
查看答案和解析>>
科目: 来源: 题型:
【题目】铜及其合金是人类最早使用的金属材料。
(1)下图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为___________。

(2)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有_____________(填序号)。
A.配位键 B.金属键 C.极性共价键 D.非极性共价键 E.离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___________。
(3)第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。
①H、C、N、O四种元素的电负性由小到大的顺序为_______________________。
②下列叙述不正确的是____________。(填字母)
A.因为HCHO与水分子间能形成氢键,所以CH2O易溶于水
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个![]() 键和1个大
键和1个大![]() 键,C2H2是非极性分子
键,C2H2是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式________________。
(4)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。与Fe原子或离子形成配合物的分子或离子应具备的结构特征是_________ 写出一种与 CN- 互为等电子体的单质分子式_______________________。
(5)一种Al-Fe合金的立体晶胞如下图所示。请据此回答下列问题:
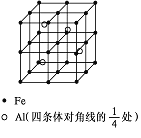
①确定该合金的化学式______________。
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为__________cm。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯仿(CHCl3)常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2―→2HCl +2COCl2。下列说法不正确的有

A. CHCl3分子的空间构型为正四面体
B. COCl2分子中中心C原子采用sp2杂化
C. COCl2分子中所有原子的最外层电子都满足8电子稳定结构
D. 使用前可用硝酸银稀溶液检验氯仿是否变质
查看答案和解析>>
科目: 来源: 题型:
【题目】元素X、Y、Z在周期表中的相对位置如图所示。已知Y元素原子的外围电子排布为ns(n-1)np(n+1),则下列说法不正确的是( )
![]()
A. Y元素原子的外围电子排布为4s24p4
B. Y元素在周期表的第三周期ⅥA族
C. X元素所在周期中所含非金属元素最多
D. Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y是主族元素,I为电离能,单位是KJ/mol.根据下表所列数据判断错误的是( )
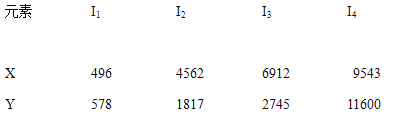
A. 元素X的常见化合价是+1价
B. 元素Y是ⅢA族的元素
C. 元素X与氯形成化合物时,化学式可能是XCl
D. 若元素Y处于第3周期,它可与冷水剧烈反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com