
科目: 来源: 题型:
【题目】向10mL1mol·L-1的HCOOH溶液中不断滴加1mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lgc水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是( )

A.常温下,Ka(HCOOH)的数量级为10-4
B.a、b两点pH均为7
C.从a点到b点,水的电离程度先增大后减小
D.混合溶液的导电性逐渐增强
查看答案和解析>>
科目: 来源: 题型:
【题目】G是药物合成中的一种重要中间体,下面是G的一种合成路线:


回答下列问题:
(1)B的结构简式为__________,其中所含官能团的名称为__________;B生成C的反应类型为__________。
(2)D的名称是__________。
(3)由C和E合成F的化学方程式为________________________________________。
(4)D的同分异构体中,能发生银镜反应且分子结构中含苯环的还有__________种,其中核磁共振氢谱上有6组峰,峰面积之比为1∶1∶1∶1∶1∶1的同分异构体的结构简式为______________________ (一种即可)。
(5)参照上述合成路线,以CH3CH2Cl为原料(其他试剂任选),设计制备巴豆醛(CH3CH=CH
CHO)的合成路线。_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】在化合物YX2和ZX2中,已知X、Y、Z都是前三周期的元素,X与Y同周期,Y与Z同主族,Y原子的最外层电子数是次外层电子数的2倍;X原子最外层上有6个电子。根据以上条件,回答问题:
(1)Y的原子结构示意图为___。
(2)YX2的结构式是___,分子内的共价键是___(填“极性键”或“非极性键”)。
(3)ZX2的化学式为___。
(4)用电子式表示YX2的形成过程___。
查看答案和解析>>
科目: 来源: 题型:
【题目】有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如图示的装置进行试验。通入二氧化硫气体,将带余烬的木条插入试管中,木条复燃。
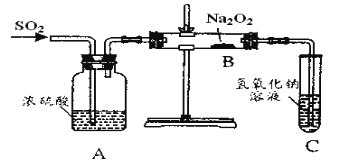
请回答下列问题:
(1)第一小组同学认为Na2O2与SO2反应生成的白色固体中含有Na2SO3和O2该反应的化学方程式为___。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3___。
(3)第二小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
将B中反应后的固体溶解于水(再加BaCl2溶液)→白色沉淀→(加入稀硝酸)仍有部分白色沉淀不溶解,证明有Na2SO4生成。上述方案是否合理?___;请简要说明理由:__。
(4)在100mL混合溶液中,HNO3和H2SO4的物质的量浓度分别是0.4mol/L,0.1mol/L向该混合液中加入1.92g铜粉,加热待充分反应后,所得溶液中Cu2+的物质的量浓度是__(填选项字母)。
A.0.15 B.0.225 C.0.35 D.0.45
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验可以达到目的或得出结论的是( )
选项 | 实验目的或结论 | 实验过程 |
A | 探究浓硫酸的脱水性 | 向表面皿中加入少量胆矾,再加入约3mL浓硫酸,搅拌,观察实验现象 |
B | 相同温度下,Ksp(ZnS)<Ksp(CuS) | 向2mL ZnSO4 和CuSO4的混合溶液中逐滴加入0.01mol/L Na2S溶液,先出现白色沉淀 |
C | 淀粉已经完全水解 | 取少量酸催化后的淀粉水解液于试管中,先加入过量氢氧化钠溶液中和酸,再加少量碘水,溶液未变蓝 |
D |
| 向NaAlO2的试管中滴加碳酸氢钠溶液,产生白色沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸盐与钴(Ⅲ)形成的一种配合物1Co(NH3)5NO2]Cl2的制备流程如下:
![]()
(1)Co2+基态核外电子排布式为 。
(2)配合物1Co(NH3)5Cl]Cl2中与Co3+形成配位键的原子为 (填元素符号);配离子 1Co(NH3)5NO2]2+的配体中氮原子的杂化轨道类型为 。
(3)与NO2-互为等电子体的单质分子为 (写化学式)。
(4)H2O2与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为 。
(5)亚硝酸盐在水体中可转化为强致癌物亚硝胺,亚硝胺NDMA的结构简式如图所示,1molNDMA分子中含有![]() 键的数目为 mol。
键的数目为 mol。
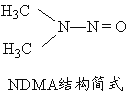
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。其中X与Y可形成一种淡黄色物质P,常温下将0.05mol P溶于水,配成1L溶液,其中![]() ;Z为金属元素,且Z可在W的一种氧化物中燃烧,生成一种白色的物质和一种黑色的物质。下列说法错误的是( )
;Z为金属元素,且Z可在W的一种氧化物中燃烧,生成一种白色的物质和一种黑色的物质。下列说法错误的是( )
A.简单离子半径:X>Y>Z
B.氢化物的沸点:W<X
C.化合物P中既含有离子键又含有共价键
D.W、X、Y三种元素形成的物质的水溶液显碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。请完成下列问题:
(1)Z元素的名称是___。
(2)XZ3化合物的化学式是___,电子式是__。
(3)分别写出X、Y的含氧酸的化学式__、__。
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g) △H=____kJ·mol-1。
CH3OCH3(g)+CO2(g) △H=____kJ·mol-1。
下列措施中,能提高CH3OCH3产率的有____。
A.使用合适的催化剂 B.升高温度 C.增大压强
(2)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是____。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是____。
A.△H < 0
B.P1<P2<P3
C.若在P3和316℃时,起始n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%

(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为____时最有利于二甲醚的合成。
(4)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,b电极的电极反应式为____。
(5)甲醇液相脱水法制二甲醚的原理是:
CH3OH +H2SO4 → CH3HSO4+H2O,
CH3 HSO4+CH3OH → CH3OCH3+H2SO4。
与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是
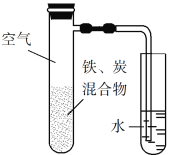
A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com