
科目: 来源: 题型:
【题目】(1)氢气是一种未来十分理想的能源。
镧镍合金是一种良好的储氢材料,在一定条件下通过如下反应实现储氢:
LaNi3(s)+3H2(g) ![]() LaNi3H6(s) H<0。 某实验室模拟该过程,向体积一定的密闭容器中充入反应物发生反应。H2的平衡转化率与其初始加入量(n)、反应温度(T)的关系如下左图所示;一定温度(T)下,将a mol的氢气充入体积是1 L的容器内,气体的压强(P)随时间(t)的变化关系如下右图所示:
LaNi3H6(s) H<0。 某实验室模拟该过程,向体积一定的密闭容器中充入反应物发生反应。H2的平衡转化率与其初始加入量(n)、反应温度(T)的关系如下左图所示;一定温度(T)下,将a mol的氢气充入体积是1 L的容器内,气体的压强(P)随时间(t)的变化关系如下右图所示:

①n1、n2、n3的大小关系是_______。
②温度T1下反应的平衡常数是__________(用含a的代数式表示)。
③保持温度不变,在t6时刻将容积压缩至原容积的一半,容器内的压强_________6kPa(填写“大于”或“小于”)。
(2)贮氢合金ThNi5可催化由CO、H2合成CH4等有机化工产品的反应。温度为TK时发生以下反应①![]()
②![]()
③![]()
![]() _______。
_______。
(3)TK时,向一恒压密闭容器中充入等物质的量的CO(g)和H2O(g)发生上述反应②(已排除其他反应干扰),测得CO(g)物质的量分数随时间变化如下表所示:

若初始投入CO为2 mol,恒压容器容积10 L,用H2O(g)表示该反应0-5分钟内的速率v[H2O(g)]=______。6分钟时,仅改变一种条件破坏了平衡,且第9min达到平衡时,CO的物质的量是0.2mol,则改变的外界条件为_________。
(4)温度、压强对反应CO(g)十2H2(g)=CH3OH(g) H=-90. 1 kJ·mol-1中CO转化率的影响如图所示:

①温度在较低范围内,对CO转化率影响的主要因素是____________ (填“温度”或“压强”)。
②由图像可知,温度越低,压强越大,CO转化率越高。但实际生产往往采用300~400 °C和10 MPa的条件,其原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组探究肉桂酸的制取:
I:主要试剂及物理性质

注意:乙酸酐溶于水发生水解反应
II :反应过程.
实验室制备肉桂酸的化学方程式为: 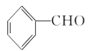 +(CH3CO2)O
+(CH3CO2)O![]()
![]() +CH3COOH
+CH3COOH
III::实验步骤及流程
①在250 mL三口烧瓶中(如图甲)放入3 ml(3. 15 g,0. 03 mol)新蒸馏过的苯甲醛、8 ml(8. 64g,0. 084 mol)新蒸馏过的乙酸酐,以及研细的4.2 g无水碳酸钾。采用空气冷凝管缓缓回流加热45min。由于反应中二氧化碳逸出,可观察到反应初期有大量泡沫出现。
②反应完毕,在搅拌下向反应液中分批加入20 mL水,再慢慢加入碳酸钠中和反应液至pH等于8。然后进行水蒸气蒸馏(如图乙),待三口烧瓶中的剩余液体冷却后,加入活性炭煮沸10-15 min,进行趁热过滤。在搅拌下,将HCl加入到滤液中,当固体不在增加时,过滤,得到产品,干燥,称量得固体3.0 g。
IV:如图所示装置:

回答下列问题:
(1)合成时装置必须是干燥的,理由是___________。反应完成后分批加人20mL水,目的是________。
(2)反应完成后慢慢加入碳酸钠中和,目的是_____。
(3)步骤②进行水蒸气蒸馏,除去的杂质是______,如何判断达到蒸馏终点__________。
(4)加入活性炭煮沸10- 15 min,进行趁热过滤,将滤液冷却至室温,趁热过滤的目的是_______。
(5)若进一步提纯粗产品,应用的操作名称是______,该实验产品的产率约是_______。(保留小数点后一位)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列过程表达式中,属于电离方程式的是( )
A. HSO3-+H3O+![]() H2SO3+H2OB. NH3·H2O
H2SO3+H2OB. NH3·H2O![]() NH4++OH-
NH4++OH-
C. CH3COO-+H2O![]() CH3COOH+OH-D. HCO3-+OH-=H2O+CO32-
CH3COOH+OH-D. HCO3-+OH-=H2O+CO32-
查看答案和解析>>
科目: 来源: 题型:
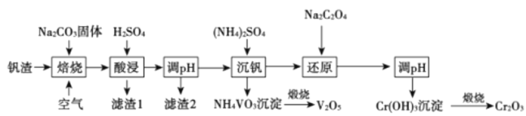
【题目】某高铬型钒渣含Fe2O3、Fe3O4、SiO2、Al2O3、V2O5、Cr2O3等物质,从中分离提取钒和铬的工艺流程如图所示:
回答下列问题:
(1)“焙烧”时V2O5、Cr2O3转化为NaVO3和Na2CrO4,SiO2、Al2O3转化为________和_______。
(2)滤渣1中主要含______。 滤渣2的主要成分是Fe(OH)3和Al(OH)3,对应调pH应不低于______。(常温下,当溶液中离子浓度小于1×10-5mol/L时认为沉淀完全, Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=1.0×10-33)。
(3)“沉钒”时的离子方程式是_______,NH4VO3煅烧过程中的化学方程式是______。
(4)“还原”时溶液的pH在2.5左右,反应的离子方程式是________。
(5)已知:25 °C时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6. 4×10-5,则25° C时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为_____,向0.1 mol· L-1H2C2O4溶液中加入一定的NaOH固体,当溶液的pH= 2.5时,溶液中c(C2O42-) :c(H2C2O4)=_______(保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有甲、乙两个装置,下列说法错误的是( )
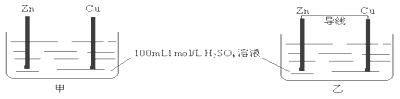
A. 甲、乙装置中,Zn的质量均减小B. 甲、乙装置中,Cu上均有气泡产生
C. 化学反应速率乙>甲D. 甲中H+移向Zn,乙中H+移向Cu
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家采用碳基电极材料设计了一种制取氯气的新工艺方案,装置如图所示:下列说法错误的是( )
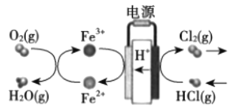
A.反应过程中需要不断补充Fe2+
B.阳极反应式是2HCl- 2e- =Cl2+2H+
C.电路中转移1 mol电子,消耗标况下氧气5.6 L
D.电解总反应可看作是4HCl(g)+O2(g)=2Cl2(g) + 2H2O(g)
查看答案和解析>>
科目: 来源: 题型:
【题目】苯的结构简式可用![]() 来表示,下列关于苯的叙述中正确的是
来表示,下列关于苯的叙述中正确的是
A. 苯主要是以石油为原料而获得的一种重要化工原料
B. 苯中含有碳碳双键,所以苯属于烯烃
C. 苯分子中6个碳碳化学键完全相同
D. 苯可以与溴水、高锰酸钾溶液反应而使它们褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期中的三种元素X、Y、Z的原子序数依次减小,三种元素原子核外电子层数之和是5,X元素原子的最外层电子数是Y和Z两元素原子的最外层电子数的总和;Y元素原子的最外层电子数是它的电子层数的2倍,且Y元素最高正价与最低负价的绝对值相等,X和Z可以形成XZ3的化合物。请回答:
(1)X、Y、Z三种元素的元素符号分别为X_____,Y_____,Z______;
(2)元素X的原子得电子能力__(填"强于"或"弱于")元素Y的原子,用最简单的实验验证(用化学方程式表示)__
(3)XZ3的电子式是_______;
(4)写出向XZ3的水溶液中通入过量Y的最高价氧化物反应的化学方程式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在试管A中加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯。
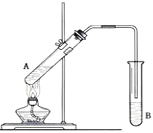
(1)试管B中盛放的溶液是_____________,其作用是:_____________
(2)反应的化学方程式是____________
(3)分离产物用的仪器是___________
查看答案和解析>>
科目: 来源: 题型:
【题目】25 °C时,用浓度为0.1000 mol/L的NaOH溶液滴定体积均是20mL、浓度均为0.1000 mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是( )
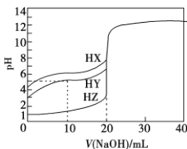
A.酸性强弱顺序是HX> HY> HZ
B.加入10 mL NaOH溶液时,HY溶液中c(Na+ )>c(Y -)
C.pH=2的HZ溶液加水稀释10倍,pH为3
D.加入20 mL NaOH溶液时,只有HY溶液达到滴定终点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com