
科目: 来源: 题型:
【题目】氯化苄(C6H5CH2Cl)是一种重要的有机化学原料。工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄。
(1)写出实验室制取氯气的化学方程式___。
(2)用下列方法分析氯化苄粗产品的纯度。
步骤1:称取5.11g样品于烧瓶中,加入200.00mL4mol/L氢氧化钠溶液共热,冷却至室温。加入 200.00mL4mol/L硝酸,一段时间后,将烧瓶中的溶液全部转移至250.00 mL 的容量瓶中,加水定容。
步骤Ⅱ:从能瓶中各収25.00 mL溶液于三只锥形瓶中,各加入25.00 mL0.2000mol/L硝酸银溶液。
歩骤Ⅲ:以硫酸铁铵作指示剂,用0.2000 mol/LNH4SCN溶液分别滴定剩余的硝酸银,所得滴定数据如下表。
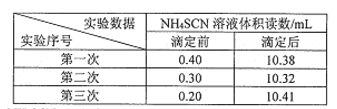
①加入硝酸的目的是_________。
②在步骤Ⅲ操作中,判断达到滴定终点的现象是_______。
③该样品中氯化苄的质量分数(写出计算过程)__________。
④上述测定结见迎常商于氯化苄中筑元素的理论含量,原因是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】温度T℃时,在3个1L的恒容密闭容器中发生:C0(g)+H20(g)= C02(g) + H2(g) △H =-41kJmol-1,其起始时投料的方式、各物质的量及其达平衡过程体系热量的变化入下表所示:
容器编号 | 起始各物质物质的量/mol | 达平衡过程体系热量的变化(均为正值) | |||
C0 | H20(g) | C02 | H2 | ||
① | 1 | 4 | 0 | 0 | 32.8kJ |
② | 8 | 2 | 0 | 0 | Q1 |
③ | 0 | 0 | 1 | 4 | Q2 |
下列说法中正确的是
A. 若经过10s容器①中反应达到平衡,则v(CO)=0.08molL-1s-1
B. 容器②和容器③中热量变化:Q2=Q1=32.8kJ
C. 若加入催化剂,改变了该反应的途径,反应的△H也随之改变
D. 保持相同条件,向平衡后的容器①中再加入0.2molCO(g)和0.8molCO2(g) ,则平衡不发生改变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 反应 2NaCl(s) = 2Na(s)+Cl2(g)的 △H>0, △S>0
B. 常温下,将稀CH3COONa溶液加水稀释后,恢复至原温度,pH增大和Kw不变
C. 合成氨生产中将NH3液化分离,可加快正反应速率,提高H2的转化率
D. 氢氧燃料电池工作时,若消耗标准状况下11.2LH2,则转移电子数为6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】为研究沉淀的生成及其转化,某小组进行如下实验。关于该实验分析不正确的是( )

A.①浊液中存在平衡:AgSCN(s) ![]() Ag+(aq)+SCN-(aq)
Ag+(aq)+SCN-(aq)
B.②中颜色变化说明上层清液中含有SCN-
C.③中颜色变化说明有AgI生成
D.该实验可以证明AgI比AgSCN更难溶
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,不正确的是
A. 固体表面水膜的酸性很弱或呈中性,发生吸氧腐蚀
B. 钢铁表面水膜的酸性较强,发生析氢腐蚀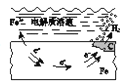
C. 将锌板换成铜板对钢闸门保护效果更好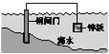
D. 钢闸门作为阴极而受到保护
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来分枝酸称为某些生化研究的热点,其结构如图所示。下列关于分枝酸的说法,正确的是( )
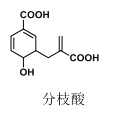
A.该化合物的分子式为C11H12O5,且含有两种官能团
B.能使酸性高锰酸钾溶液褪色,也能使溴的四氯化碳溶液褪色,且原理相同
C.1mol 分枝酸最多能与 3mol NaOH 发生中和反应
D.1mol 分枝酸与1mol Br2发生加成反应,可能得到4 种产物
查看答案和解析>>
科目: 来源: 题型:
【题目】AG 定义为 AG= lg![]() ,若用 AG 来表示溶液的酸度,说法不正确的是
,若用 AG 来表示溶液的酸度,说法不正确的是
A.在一定温度下,溶液的酸性越强,AG 越大
B.65℃时,pH 与 AG 的换算公式为 AG = 2 (7 – pH)
C.若溶液显碱性,则 AG < 0
D.若溶液显中性,则 AG = 0
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 向氨水中通入少量二氧化硫:NH3H2O+SO2═NH4++HSO3-
B. 向氯化铝溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
C. 电解氯化镁溶液:2Cl-+2H2O ![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
D. 氢氧化钡溶液中滴入硫酸氢钠溶液至Ba2+恰好完全沉淀:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X(g)+3Y(g)2Z(g),其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.改变压强,平衡常数不变,平衡不移动
查看答案和解析>>
科目: 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
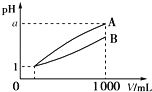
A.若a=4,则A是强酸,B是弱酸
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.稀释前两种酸溶液的浓度:c(A)>c(B)
D.若1<a<4,则A、B都是弱酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com