
科目: 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是
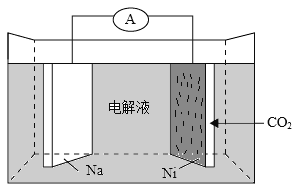
A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在实验报告中记录下列数据,其中正确的是
A. 用 100 mL 量筒量取 12.5 mL 盐酸
B. 称量 NaOH 固体时,将 NaOH 直接放在托盘上的纸上
C. 需用 220 mL, 1 mol·L-1 CuSO4 溶液,配制时需称 62.5g 的 CuSO4·5H2O 晶体
D. 配制稀硫酸时,先向烧杯中注入浓硫酸,再加水稀释
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知水在25℃和100℃时,其电离平衡曲线如图所示:
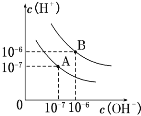
①则25℃时水的电离平衡曲线应为_____。(填“A”或“B”)
②25℃下,下列三种溶液中,由水电离出的氢离子的物质的量浓度之比a:b:c=_____。
a.pH=1的盐酸b.pH=2的盐酸c.pH=12的NaOH溶液
③25℃下,若VaLpH=a的盐酸与VbLpH=b的NaOH溶液恰好中和,a+b=13,则Va:Vb=_____。
(2)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=13。
①该温度下水的Kw=_____。
②此温度下,将pH=1的盐酸溶液VaL与pH=14的NaOH溶液VbL混合(忽略体积变化),混合后溶液的pH为2,则Va:Vb=_____。
(3)下列说法中正确的是_____。
a.25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液pH>7
b.100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液恰好中和,所得溶液pH=7
c.25℃时,由水电离出的氢离子浓度为1×10-10mol/L的溶液中可能大量存在NH4+和Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
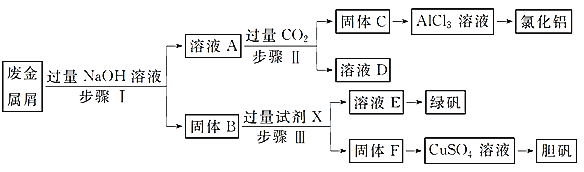
请回答:
⑴写出步骤Ⅰ反应的离子方程式:_______________________。
⑵试剂X是______________。D是______________。
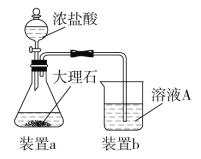
⑶在步骤Ⅱ时,用如图装置制取CO2并通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是_____________________。
⑷由固体F制取硫酸铜溶液,通常有两种方案:
方案一:将固体F在加热条件下与浓硫酸反应;
方案二:将固体F投入热的稀硫酸中,然后通入氧气;
方法一的缺点为:_________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应aA(g)+bB(g)cC(g) ΔH<0在等容条件下进行。改变其它反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示,下列说法不正确的是
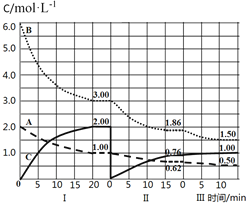
A.反应的化学方程式中,a:b:c=1:3:2
B.第II阶段反应温度小于第III阶段反应温度
C.A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A),最大的是vⅠ(A)
D.由第一次平衡到第二次平衡,采取的措施是从反应体系中移走C
查看答案和解析>>
科目: 来源: 题型:
【题目】在一容积为2 L的恒容密闭容器中加入0.2 mol CO和0.4 mol H2,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g) 实验测得300℃和500℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
CH3OH(g) 实验测得300℃和500℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
10min | 20min | 30min | 40min | 50min | 60min | |
300℃ | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
500℃ | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
A. 该反应的焓变ΔH > 0,升高温度K增大
B. 300℃时,0-20 min H2的平均反应速率 v (H2)= 0.003mol/(L·min)
C. 采取加压、增大H2浓度、加入催化剂的措施都能提高CO的转化率
D. 500℃下,向该容器中初始加入0.1 mol CO和0.3 mol H2,依据现有数据可计算反应达平衡后甲醇的浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g) + 3H2(g) ![]() 2NH3(g)△H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g)△H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量a kJ |
② | 2 | 3 | 0 | 放出热量b kJ |
③ | 2 | 6 | 0 | 放出热量c kJ |
下列叙述正确的是
A. 放出热量关系:a < b <92.4
B. 三个容器内反应的平衡常数:③>①>②
C. 达平衡时氨气的体积分数:①>③
D. N2的转化率:②>①>③
查看答案和解析>>
科目: 来源: 题型:
【题目】现有 A、B、C、D、E、F 六种短周期主族元素,其相关性质信息如下:
元素 | 相关信息 |
A | 地壳中含量最多的金属元素 |
B | 原子核外电子数和周期序数相等 |
C | 最外层电子数是次外层电子数的 3 倍 |
D | 最高正价与最低负价代数和为 4,常温下单质为固体 |
E | 在短周期元素中,原子半径最大 |
F | M 层比L 层少 1 个电子 |
请根据上述信息,完成下列问题:
(1)请给出元素 D 在元素周期表中的位置:________。
(2)请将 A、D、E、F 四种元素的简单离子按照离子半径由大到小排序(用离子符号表示):__________。
(3)请给出化合物 BFC 的电子式:______。
(4)用电子式表示 E 与 F 形成化合物 EF 的过程:______。
(5)请将 A、D、F 三种元素的最高价氧化物对应的水化物按照酸性由强到弱排序(用化学式表示):__________。
(6)元素 A 的单质常用于野外焊接钢轨,请写出该反应的化学方程式:________。
(7)单质 A 能溶于 E 的最高价氧化物对应水化物的水溶液,请给出该反应的离子方程式:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】酮洛芬是一种良好的抗炎镇痛药,可以通过以下方法合成:
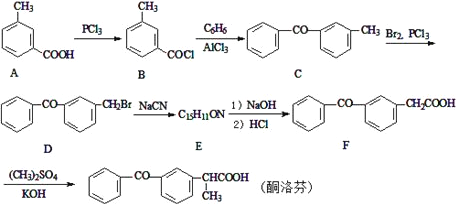
(1)化合物D中所含官能团的名称为___。
(2)化合物E的结构简式为________;由B→C的反应类型是____。
(3)写出C→D的反应方程式_____。
(4)写出同时满足下列条件的A的一种同分异构体的结构简式____。
I.能发生银镜反应;
Ⅱ.与FeCl3发生显色反应;
Ⅲ.分子中含有5种不同化学环境的氢
(5)请写出以甲苯为原料制备化合物![]() 的合成路线流程图(无机试剂和有机溶剂可任选,合成线路流程图示例见并难题题干)____。
的合成路线流程图(无机试剂和有机溶剂可任选,合成线路流程图示例见并难题题干)____。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知卤代烃在碱性条件下可以发生如下水解反应:(R 代表烃基)R—X+NaOH![]() R—OH+NaBr。A、B、C、D、E、F、G、H 八种有机化合物有如下转换关系,部分化合物的分子式已给出。
R—OH+NaBr。A、B、C、D、E、F、G、H 八种有机化合物有如下转换关系,部分化合物的分子式已给出。
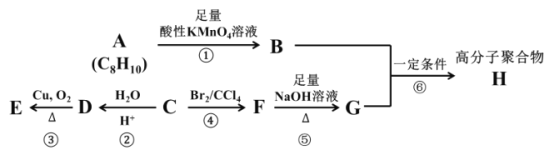
其中,某烃 C 是重要的石油化工产品,其产量可以用来衡量一个国家的石油化工发展水平。化合物 A 属于芳香烃,且苯环上的所有氢原子等效(处于相同的化学环境)。高分子聚合物 H 是工业上重要的聚酯纤维,被大量用于制作矿泉水瓶和衣物纤维。请根据上述信息,回答下列问题:
(1)化合物 A 的结构简式为 _______,A 的二氯代物有____种,A 的分子中最多可能有____个原子共平面。
(2)反应②的反应类型是 _____,化合物 D 中官能团的名称为 ______。
(3)请写出反应③的化学反应方程式______。
(4)请写出反应⑥的化学反应方程式______,并指出该反应的反应类型:_____。
(5)二取代芳香族化合物 I 是化合物 B 的同分异构体,且满足下列条件:
①能发生银镜反应;②不能与NaHCO3 溶液反应生成CO2;③苯环上只含有一种取代基
试写出 I 的任意两种可能的结构简式:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com