
科目: 来源: 题型:
【题目】![]() 和
和![]() 为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素,![]() 同主族且能形成离子化合物,
同主族且能形成离子化合物,![]() 的最外层电子数是
的最外层电子数是![]() 质子数之和的一半,
质子数之和的一半,![]() 原子的核外电子数为偶数。四种元素组成的一种化合物
原子的核外电子数为偶数。四种元素组成的一种化合物![]() 具有下列性质。下列说法正确的是( )
具有下列性质。下列说法正确的是( )
白色沉淀![]() M
M![]() 溶液褪色并产生气泡
溶液褪色并产生气泡
A.原子半径:![]()
B.![]() 使溴水褪色体现氧化性
使溴水褪色体现氧化性
C.简单氢化物的稳定性:![]()
D.![]() 与
与![]() 均能形成具有漂白性的物质
均能形成具有漂白性的物质
查看答案和解析>>
科目: 来源: 题型:
【题目】微生物燃料电池(MFC)为可再生能源的开发和难降解废弃物的处理提供了一条新途径。某微生物燃料电池示意图如图所示(假设废弃物为乙酸盐)。下列说法错误的是( )
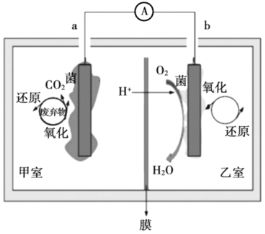
A.甲室菌为好氧菌,乙室菌为厌氧菌
B.甲室的电极反应式为![]()
C.该微生物燃料电池(MFC)电流的流向:由b经导线到a
D.电池总反应式为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】最近罗格斯大学研究人员利用电催化技术高效率将CO2转化为X和Y(如下图), X、Y可用作制备塑料、粘合剂和药品的前体等。下列说法正确的是
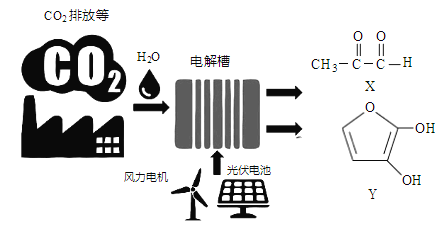
A. 图中能量转换方式只有2种
B. X、Y分子中所含的官能团相同
C. X、Y均是电解时的阳极产物
D. CO2资源化利用有利于解决大气中CO2浓度增加导致的环境问题
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酸异戊酯是蜜蜂信息素的成分之一,具有香蕉的香味。实验室中可利用乙酸和异戊醇![]() 制备乙酸异戊酯,装置图(夹持装置略)和所用药品有关数据如下。下列说法正确的是( )
制备乙酸异戊酯,装置图(夹持装置略)和所用药品有关数据如下。下列说法正确的是( )

药品 | 密度/( | 沸点/℃ | 水中溶解性 |
异戊醇 | 0.8123 | 131 | 微溶 |
乙酸 | 1.0492 | 118 | 易溶 |
乙酸异戊醇 | 0.8670 | 142 | 难溶 |
A.反应方程式为CH3COOH+![]()
![]()
![]()
B.实验时,冷凝水应从直形冷凝管的b口通入
C.异戊醇的同分异构体中属于醇类的有7种
D.反应后,取Ⅱ中物质经水洗、碱洗和蒸馏可提纯乙酸异戊酯
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语表示正确的是
A. 羟基的电子式:![]()
B. 甘氨酸的结构简式:C2H5NO2
C. AlCl3溶液中Al3+水解的离子方程式:Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
D. 粗铜(含Cu及少量Zn、Fe、Ag等)电解精炼时,阳极主要发生反应:Ag-e-=Ag+
查看答案和解析>>
科目: 来源: 题型:
【题目】判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示:
含氧酸酸性强弱与非羟基氧原子数的关系
次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
含氧酸 | Cl—OH |
|
|
|
非羟基氧原子数 | 0 | 1 | 2 | 3 |
酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
(1)已知,亚磷酸是中强酸,亚砷酸是弱酸且有一定的弱碱性,则H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是①_____________________________,②__________________________________。
(2)在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况______________,写出化学方程式:____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂(LiFePO4)。LiFePO4的一种制备方法如图。
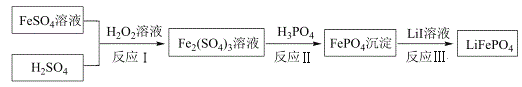
已知:H3PO4能电离出PO![]() 。
。
(1)LiFePO4中,铁元素的化合价为_____。
(2)反应I中H2O2的作用是_____。
(3)检测反应II中铁离子是否完全反应的操作是_____。(离子检验常用的表达方式为:取xx试剂,向其中滴加xx,若出现xx现象,则说明xx结论。)
(4)反应Ⅲ的化学方程式是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。化工厂常用浓氨水来检验氯气管道是否发生泄漏,其原理是:
为阿伏加德罗常数的值。化工厂常用浓氨水来检验氯气管道是否发生泄漏,其原理是:![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.如果氯气管道漏气,则会看到有大量白雾生成
B.反应中每形成![]() 键,转移电子数为
键,转移电子数为![]()
C.![]() 的
的![]() 溶液中,
溶液中,![]() 的数目小于
的数目小于![]()
D.该反应中,氧化剂与还原剂的物质的量之比为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。生产钕铁硼磁铁的主要原材料有稀土金属钕、高纯铁、铝、硼等。回答下列问题:
(1)钕(Nd)为60号元素,在周期表中位于第_________周期。基态硼原子中占据最高能级的电子,电子云轮廓图形状为_______。铁离子的电子排布式__________________
(2)实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如下图所示:
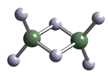
① 分子中A1原子采取____杂化。Al2Cl6属于____分子(填“极性”或“非极性”)。
②AlCl3与过量NaOH溶液反应生成Na[Al(OH)4],[A1(OH)4]-中存在的化学键有_________(填选项字母)。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
(3)工业上可用电解熔融的FeO、Fe2O3冶炼高纯铁。基态Fe2+的价电子排布图(轨道表达式)为______________;用物质结构知识说明Fe2+容易被氧化成Fe3+的原因:________________________。
(4)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为_____。
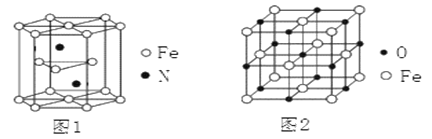
(5)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm—3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_________;Fe2+与O2—的最短核间距为_____________pm。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图装置可验证同主族元素非金属性的变化规律。
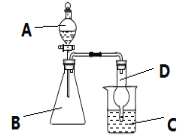
(1)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液___的现象,即可证明。从环保角度考虑,此装置缺少尾气处理装置,可用___溶液吸收尾气。请写出一种制氯气的化学反应方程式:___。
(2)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液___的现象,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有___溶液的洗气瓶。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com