
科目: 来源: 题型:
【题目】金属元素Fe、Ni、Pt均为周期表中同族元素,该族元素的化合物在研究和生产中有许多重要用途。
(1)Fe是常见的金属,生活中用途广泛。请回答下列问题:
①Fe在元素周期表中的位置为________________________。
②Fe的一种晶胞结构如图所示,测得晶胞边长为 a pm,则Fe原子半径为__________。
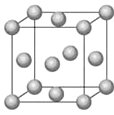
③已知:FeO晶体晶胞结构为NaCl型,与O2-距离最近且等距离的亚铁离子围成的空间构型为________。
(2)铂可与不同的配体形成多种配合物,分子式为[Pt(NH3)2Cl4]的配合物的配体是_________;该配合物有两种不同的颜色,其中橙黄色比较不稳定,在水中的溶解度大;呈亮黄色的物质在水中的溶解度小,如下图所示的结构示意图中呈亮黄色的是_____(填“A”或“B”),理由是___________。
A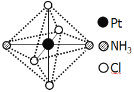 B
B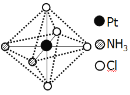
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图。
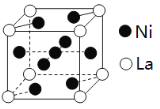
①测知镧镍合金晶胞体积为9.0×10-23cm3,则镧镍合金的晶体密度为____________ (不必计算结果) 。
②储氢原理为:镧镍合金吸附H2,H2解离为原子,H原子储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱和面心,则形成的储氢化合物的化学式为____________。
(4)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用![]() 表示,其中m、n分别代表参与形成大π键的电子数和原子个数,如苯分子中大π键表示为
表示,其中m、n分别代表参与形成大π键的电子数和原子个数,如苯分子中大π键表示为![]() 。 下列微粒中存在“离域Π键”的是__________。
。 下列微粒中存在“离域Π键”的是__________。
a.O3 b.SO42- c.H2S d.NO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】食盐中所加的碘以碘酸钾(KIO3)形式存在。根据反应:IO![]() +I-+H+→I2+H2O(未配平),可用KI淀粉试纸和食醋进行实验,证明加碘食盐中存在IO
+I-+H+→I2+H2O(未配平),可用KI淀粉试纸和食醋进行实验,证明加碘食盐中存在IO![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
A.上述反应中氧化剂和还原剂的物质的量之比为1∶5
B.实验时可观察到试纸变蓝
C.实验可证明该条件下I-的还原性强于Cl-
D.食醋中含有的乙酸是强酸,它能提供反应所需的H+
查看答案和解析>>
科目: 来源: 题型:
【题目】根据物质结构有关性质和特点,回答下列问题:
(1)Ti基态原子核外电子排布式为____________,碳原子的价电子轨道表示式为________。
(2)钛存在两种同素异形体,α—Ti采纳六方最密堆积,β—Ti采纳体心立方堆积,由α—Ti转变为β—Ti晶体体积____________(填“膨胀”或“收缩”)。
(3)写出一种与NH4+互为等电子体物质的化学式____________。
(4)SO2的空间构型为___________________。
(5)丙烯腈(CH2=CH—CN)分子中σ键和π键的个数比为____,分子中碳原子轨道杂化类型是______。
(6)FeCl3熔点282℃,而FeCl2熔点674℃,二者熔点差异的原因是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】过二硫酸钾(K2S2O8)在科研与工业上有重要用途。
(1)S2O82-的结构式为[![]() ]2-,其中S元素的化合价为_____。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是_____(填离子符号)。
]2-,其中S元素的化合价为_____。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是_____(填离子符号)。
(2)某厂采用湿法K2S2O8氧化脱硝和氨法脱硫工艺综合处理燃煤锅炉烟气,提高了烟气处理效率,处理液还可以作为城市植被绿化的肥料。
①脱硫过程中,当吸收液pH=6时,n(SO32-)﹕n(HSO3-)=____。[已知:25℃时,Ka1(H2SO3)=1.5×10-2;Ka2(H2SO3)=1.0×10-7]
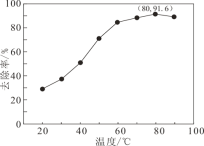
②脱硝过程中依次发生两步反应:第1步K2S2O8将NO氧化成HNO2,第2步K2S2O8继续氧化HNO2,第2步反应的化学方程式为________________________________;一定条件下,NO去除率随温度变化的关系如图所示。80℃时,若NO初始浓度为450 mg·m-3,t min达到最大去除率,NO去除的平均反应速率:v(NO) =_______mol.L-1·min-1(列代数式)。
(3)过二硫酸钾可通过“电解→转化→提纯”方法制得,电解装置如下图所示。
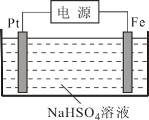
①电解时,铁电极连接电源的______极。
②常温下,电解液中含硫微粒主要存在形式与pH的关系如下图所示。已知,硫酸的二级电离常数1.02×10-2,在阳极放电的离子主要是HSO4-,阳极区电解质溶液的pH范围为________,阳极的电极反应式为________。
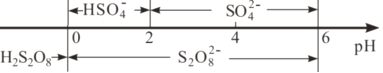
③往电解产品中加入硫酸钾,使其转化为过二硫酸钾粗产品,提纯粗产品的方法是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是______(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):
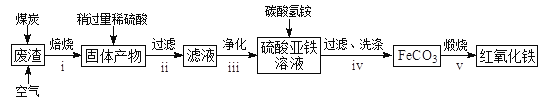
回答下列问题:
①在步骤i中产生的有毒气体可能有__________________。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上使Al3+恰好沉淀完全即溶液中c(Al3+)=1×10-5mol/L,则溶液的pH为____________。
③步骤iv中,生成FeCO3的离子方程式是_________________。
(3)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入适量氧化铜粉末会产生沉淀,写出该沉淀的化学式______________。这一过程的总反应的离子方程式______。
(4)古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)又称海波,呈无色透明状,易溶于水,不溶于乙醇,常用作棉织物漂白后的脱氯剂、定量分析中的还原剂。
Ⅰ. Na2S2O3·5H2O的制备
Na2S2O3·5H2O的制备方法有多种,其中亚硫酸钠法是工业和实验室中的主要方法:Na2SO3 + S + 5H2O ![]() Na2S2O3·5H2O
Na2S2O3·5H2O
制备过程如下:
①称取12.6g Na2SO3于100mL烧杯中,加50 mL去离子水搅拌溶解。
②另取4.0 g硫粉于200mL烧杯中,加6 mL乙醇充分搅拌均匀将其润湿,再加入Na2SO3溶液,隔石棉小火加热煮沸,不断搅拌至硫粉几乎全部反应。
③停止加热,待溶液稍冷却后加2 g活性炭,加热煮沸2分钟(脱色)。
④趁热过滤,得滤液至蒸发皿中, ______________、____________________。
⑤过滤、洗涤,用滤纸吸干后,称重,计算产率。
(1)加入的硫粉用乙醇润湿的目的是____________________________。
(2)步骤④趁热过滤的原因_____________________,空格处应采取的操作是_________________、____________________。
(3)步骤⑤洗涤过程中,为防止有部分产品损失,应选用的试剂为___________。
(4)滤液中除Na2S2O3和未反应完全的Na2SO3外,最可能存在的无机杂质是________________,生成该杂质的原因可能是____________________________。
Ⅱ.产品纯度的测定
准确称取1.00 g产品(硫代硫酸钠晶体的摩尔质量为248 g/mol),用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol/L碘标准溶液滴定至终点,消耗21.00 mL。反应的离子方程式为:2S2O32-+I2=S4O62-+2I-。
(5)计算所得产品的纯度为___________(保留三位有效数字),该数据的合理解释可能是__________(不考虑实验操作引起的误差)。
Ⅲ.产品的应用
(6)Na2S2O3常用于脱氯剂,在溶液中易被Cl2氧化为SO42-,该反应的离子方程式为 ____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一,丙的浓溶液是具有强氧化性的酸溶液,上述物质的转化关系如图所示。下列说法正确的是( )
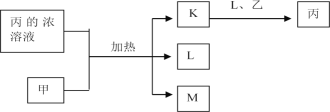
A. 电负性:W>X>YB. 原子的第一电离能:Z>Y>X
C. 由W、X、Y、Z构成化合物中只含共价键D. K、L、M中沸点最高的是M
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酰氯(SO2Cl2)和亚硫酰氯(SOCl2)常用作氯化剂,都可用于医药、农药、染料工业及有机合成工业。亚硫酰氯还用于制锂亚硫酰氯(Li/SOCl2)电池。
有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 具有吸水性且难分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,反应的热化学方程式为:SO2(g)+Cl2(g) ![]() SO2Cl2(l) △H= - 97.3 kJ·mol-1。反应装置如图所示(夹持仪器已省略),请回答有关问题:
SO2Cl2(l) △H= - 97.3 kJ·mol-1。反应装置如图所示(夹持仪器已省略),请回答有关问题:
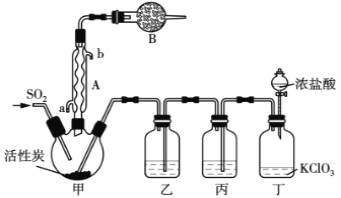
(1)仪器A的名称为___________;
(2)仪器B的作用是_____________________;
(3)装置丙中盛放的试剂为____________,在实验室用氢氧化钠吸收多余硫酰氯反应的离子方程式为___________________;
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_________(填序号)
①先通冷凝水,再通气体 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的实验操作名称为__________________,
②设计实验方案检验氯磺酸分解制取硫酰氯产品中混有硫酸,下列方案合理的是:_____(填字母)
A.取样品溶于水,滴加紫色石蕊溶液变红:再取少量溶液,加入BaCl2溶液产生白色沉淀,说明含有H2SO4。
B.取样品在干燥条件下加热至完全反应,冷却后直接加BaCl2溶液,有白色沉淀,再滴加紫色石蕊溶液变红,说明含有H2SO4。
(6)Li—SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解质溶液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2===4LiCl+S+SO2。
①写出该电池正极发生的电极反应式_______________________________
②组装该电池必须在无水、无氧的条件下进行,原因是__________________
查看答案和解析>>
科目: 来源: 题型:
【题目】实验小组进行如下实验:
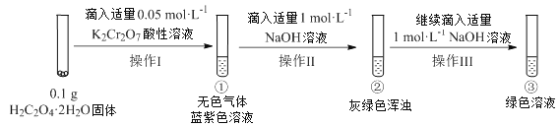
已知:Cr2(SO4)3稀溶液为蓝紫色;Cr(OH)3为灰绿色固体,难溶于水。
下列关于该实验的结论或叙述不正确的是
A. ①中生成蓝紫色溶液说明K2Cr2O7在反应中表现了氧化性
B. 若继续向③中加入稀硫酸,溶液有可能重新变成蓝紫色
C. 将①与③溶液等体积混合会产生灰绿色浑浊,该现象与Cr3+的水解平衡移动有关
D. 操作I中产生的无色气体是CO
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物![]() (x)
(x)![]() (y)
(y)![]() (z)的分子式均为C8H8,下列说法正确的是
(z)的分子式均为C8H8,下列说法正确的是
A. x、y、z均能使Br2的CCl4溶液褪色
B. x的同分异构体只有y和z
C. x、y、z的二氯代物均只有三种
D. x、y、z中只有y中所有原子可以处于同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com