
科目: 来源: 题型:
【题目】同温同压下,三个容积相同的烧瓶内分别充满了干燥的NH3、HCl、NO2气体,然后分别用水作喷泉实验,假设烧瓶内的溶质不散逸,则三种溶液的物质的量浓度之比为 ( )
A. 无法比较B. 2∶2∶3C. 3∶3∶ 2D. 1∶1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:[Cu(NH3)4]SO4易溶于水,难溶于酒精。溶液中存在平衡:I.![]()
![]()
![]() 和II.铜离子的水解平衡。下列说法不正确的是( )
和II.铜离子的水解平衡。下列说法不正确的是( )
A.[Cu(NH3)4]SO4可通过CuSO4溶液与过量氨水作用得到,其水溶液呈碱性
B.加热[Cu(NH3)4]SO4溶液,上述平衡I正向移动,Cu2+浓度增大
C.加热浓缩[Cu(NH3)4]SO4溶液,再冷却结晶,获得产品中混有CuSO4晶体
D.向[Cu(NH3)4]SO4溶液中,缓慢逐滴加入乙醇,可析出大颗粒[Cu(NH3)4]SO4晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.醋酸钠溶液呈碱性,往0.1mol·L-1醋酸溶液加入少量醋酸钠固体后,可促进醋酸电离
B.T℃时,pH为6.8的溶液,该溶液一定呈酸性
C.相同温度下,pH相等的氨水、NaOH溶液中,n(NH4+)与n(Na+)相等
D.pH相等的盐酸和醋酸溶液等体积混合(忽略温度和体积变化),混合溶液中c(Cl-) = c(CH3COO-)
查看答案和解析>>
科目: 来源: 题型:
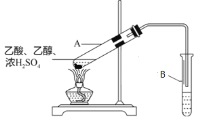
【题目】乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原 料,可用作止痛剂、退热剂、防腐剂和染料中间体。乙酰苯胺的制备原理为:
![]() +CH3COOH
+CH3COOH![]() +H2O
+H2O
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。

实验步骤:
步骤 1:在圆底烧瓶中加入无水苯胺 9.2 mL,冰醋酸 17.4 mL,锌粉0.1 g,安装仪器,加入沸石,调节加热温度,使分馏柱顶温度控制在105℃ 左右,反应约 60~80 min,反应生成的水及少量醋酸被蒸出。 步骤 2:在搅拌下,趁热将烧瓶中的物料以细流状倒入盛有 100 mL 冰 水的烧杯中,剧烈搅拌,并冷却,结晶,抽滤、洗涤、干燥,得到乙酰 苯胺粗品。步骤 3:将此粗乙酰苯胺进行重结晶,晾干,称重,计算产率。
(1)步骤 1 中所选圆底烧瓶的最佳规格是_________(填序号)。
a.25 mL b.50 mL c.150 mL d.200 mL
(2)实验中加入少量锌粉的目的是___________________________________________________________________________。
(3)从化学平衡的角度分析,控制分馏柱上端的温度在 105℃左右的原因____________________________________________________________________________。
(4)洗涤乙酰苯胺粗品最合适的方法是_____(填序号)。
a.用少量冷水洗 b.用少量热水洗 c.用酒精洗
(5)乙酰苯胺粗品因含杂质而显色,欲用重结晶进行提纯,步骤如下:热水溶解、
_______________、过滤、洗涤、干燥(选则正确的操作并排序)。
a.蒸发结晶 b.冷却结晶 c.趁热过滤 d.加入活性炭
(6)该实验最终得到纯品 8.1g,则乙酰苯胺的产率是______________ %。
(7)如图的装置有 1 处错误,请指出错误之处____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
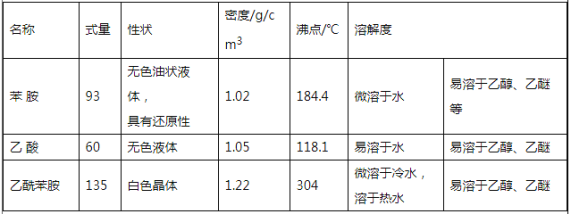
【题目】已知有机物A、B、C、D、E、F有以下转化关系。A是分子量为28的气体烯烃,其产量是衡量一个国家石油化工生产水平的标志;D是食醋的主要成分,E是不溶于水且具有香味的无色液体,相对分子质量是C的2倍,F是一种高分子化合物。结合如图关系回答问题:
(1)写出B、D中官能团的名称:B_____、D_____。
(2)写出下列反应的化学方程式:
①_____;该反应类型是_____。
②_____;该反应类型是_____。
④_____。
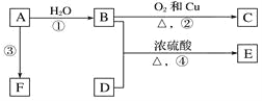
(3)实验室用如图的装置制备E,试管A中浓硫酸的作用是______;B中的试剂是______;关于该实验下列说法不正确的是______;
①加热试管A不仅可以加快反应速率,还可以蒸出E,促进反应进行
②从试管A中蒸出来的物质只有产物E
③振荡后B中油状液体层变薄主要是产物E溶解到试剂B中
④B中导管应该插入到液面以下
查看答案和解析>>
科目: 来源: 题型:
【题目】已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得
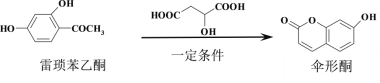
下列说法中正确的是( )
A.1mol雷琐苯乙酮最多能与3mol氢气发生加成反应
B.两分子苹果酸的一种缩合产物是:![]()
C.1mol产物伞形酮与溴水反应,最多可消耗3mol Br2,均发生取代反应
D.反应中涉及到的三种有机物都能跟FeCl3溶液发生显色反应
查看答案和解析>>
科目: 来源: 题型:
【题目】NaNO2是常用的一种防腐剂,其中+3价的N具有一定的氧化性。某实验小组利用以下反应2NO2+2NaOH=NaNO3+NaNO2+H2O制备NaNO2,并探究其性质。
I.制备NaNO2
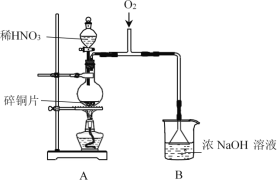
(1)A中发生反应的化学方程式是______。
(2)B中选用漏斗替代长直导管的优点是______。
(3)为检验B中制得NaNO2,甲进行以下实验:
序号 | 试管 | 操作 | 现象 |
① | 2mLB中溶液 | 加2mL0.1mol/LKI溶液,滴加几滴淀粉溶液 | 不变蓝 |
② | 2mLB中溶液 | 滴加几滴H2SO4至pH=5,加2mL0.1mol/LKI溶液,滴加几滴淀粉溶液 | 变蓝 |
③ | 2mLH2O | 滴加几滴H2SO4至pH=5,加2mL0.1mol/LKI溶液,滴加几滴淀粉溶液 | 不变蓝 |
实验③的目的是_______。
(4)乙认为上述3组实验无法证明B中一定含NaNO2,还需补充实验,理由是______。
II.探究NaNO2的性质
装置 | 操作 | 现象 |
| 取10mL1mol/LNaNO2溶液于试剂瓶中,加入几滴H2SO4酸化,再加入10mL1mol·L-1FeSO4溶液,迅速塞上橡胶塞,缓缓通入足量O2。 | i.溶液迅速变为棕色; ii.溶液逐渐变浅,有无色气泡产生,溶液上方为浅红棕色。 iii.最终形成棕褐色溶液。 |
资料:i.
ii.HNO2在溶液中不稳定,易分解产生NO和NO2气体。
(5)现象i溶液变为棕色的原因是______。
(6)已知现象ii棕色溶液变浅是由于生成了Fe3+,反应的离子方程式是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.乙醛和乙烯均能使溴水褪色,两者的反应原理不同
B.淀粉和纤维素均可以制酒精,酒精在某种微生物作用下发生氧化反应得到醋酸
C.蛋白质溶液在强酸、强碱、紫外线和加热条件下都能发生变性
D.甲苯的一氯代物有4种,甲苯与氢气加成后的产物的一氯代物也只有4种
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释事实的离子方程式不正确的是( )
A.水玻璃中滴入酚酞呈红色:SiO32-+2H2O ![]() H2SiO3+2OH-
H2SiO3+2OH-
B.Ba(NO3)2溶液中通入过量SO2:3SO2+ 3Ba2++ 2NO3- + 2H2O= 3BaSO4↓ + 2NO↑ + 4H+
C.NH4Al(SO4)2溶液中滴入过量NaOH溶液:NH4++Al3++5OH-=Al(OH)4- +NH3·H2O
D.AgNO3溶液中滴入足量氨水中:Ag++2NH3·H2O=Ag(NH3)2++2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】研究化学反应的能量变化和速率变化是研究化学反应的重要角度。
(1)化学反应中能量变化的主要原因是旧的化学键断裂会_____能量;新的化学键形成会_____能量。(填“放出”或“吸收”)
(2)用铝热法可冶炼铁,其反应为:Fe2O3+2Al![]() 2Fe+Al2O3,属于放热反应,反应物的总能量______(填“>”、“=”或“<”)生成物的总能量。在该反应中,若消耗了1molAl,则理论上可炼制Fe的物质的量为_____mol。
2Fe+Al2O3,属于放热反应,反应物的总能量______(填“>”、“=”或“<”)生成物的总能量。在该反应中,若消耗了1molAl,则理论上可炼制Fe的物质的量为_____mol。
(3)为探究反应过程中的能量变化,某小组同学用如图装置进行实验。
|
|
装置Ⅰ | 装置Ⅱ |
①装置Ⅰ中,Fe与CuSO4溶液反应的离子方程式是_____。
②装置Ⅱ中,正极的电极反应式为______。
③关于装置Ⅱ,下列叙述正确的是______(填字母)。
a.H+在Cu表面被还原,产生气泡
b.电流从Zn片经导线流向Cu片
c.电子从Zn片经导线流向Cu片
d.Zn和Cu的都是电极材料,也都参与电极反应
(4)某兴趣小组将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是_____。
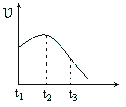
A.从t1→t2的原因是镁与酸的反应是放热反应,体系温度升高
B.从t1→t2的原因水蒸发,致使酸的浓度升高
C.从t2→t3的原因是随着反应的进行镁条的质量下降
D.从t2→t3的原因是随着反应的进行,H+的浓度逐渐下降
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com