
科目: 来源: 题型:
【题目】2022年前后我国将建成首座载人空间站。为实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家研发了一种能量转化装置,总反应方程式为2CO2=2CO+O2。下列说法正确的是( )
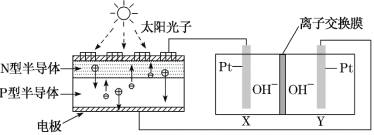
A.该装置将太阳能直接转化为化学能
B.离子交换膜为阳离子交换膜
C.反应完毕,该装置中电解质溶液的pH不变
D.Y电极的反应:CO2+2e-+H2O=CO+2OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,请用化学用语回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)⑥的氢氧化物中,所含化学键的类型是______。
(2)①和④可形成化合物,用电子式表示其形成过程______。
(3)⑦的最高价氧化物的水化物与⑧的最高价氧化物的水化物反应的离子方程式为_____。
(4)研究物质的性质差异性是学习的重要方法之一。②、③、⑧、⑨四种元素的最高价氧化物的水化物中,化学性质明显不同于其它三种酸的是______。
(5)能说明元素⑤的非金属性强于元素⑨的非金属性的实验事实是_____(填字母)。
A.两种单质的熔沸点不同
B.两种单质与氢气化合的难易程度
C.比较这两种元素的最高价氧化物的水化物的酸性
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应:CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按ω=
CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按ω=![]() 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(![]() )与温度(T)、ω的关系,图乙表示反应的平衡常数K与温度T的关系。则下列说法正确的是( )
)与温度(T)、ω的关系,图乙表示反应的平衡常数K与温度T的关系。则下列说法正确的是( )
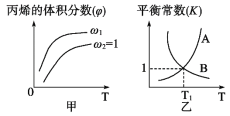
A.图甲中ω1>1
B.图乙中,线A表示正反应的平衡常数
C.在恒容容器中进行,压强不变时反应达到平衡状态
D.当温度为T1、ω=2时,Cl2的转化率约为33.3%
查看答案和解析>>
科目: 来源: 题型:
【题目】探究铁在某浓度H3PO4和H2O2的混合溶液中反应的情况,进行如下实验:
实验 | 操作 | 现象 |
Ⅰ | 将除去氧化膜的铁钉置于烧杯中,加入30mL1.0molL-1H3PO4和3mL30%H2O2的混合溶液(pH≈1)。 | 一段时间后铁钉表面突然产生大量气泡,随后停止产生气泡;一段时间后再产生大量气泡,再停止,出现周而往复的现象。过程中,溶液保持澄清。
|
Ⅱ | 将与实验Ⅰ相同的铁钉放入烧杯中,加入30mL1.0molL-1H3PO4和3mLH2O。 | 片刻后铁钉表面持续产生气泡,溶液保持澄清。 |
已知:Fe3(PO4)2难溶于水,Fe(H2PO4)2溶于水。
(1)用85%H3PO4配制100mL1.0mol·L-1H3PO4所用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、______。
(2)请结合实验Ⅱ中现象,分析铁钉与H3PO4反应的产物_______。
(3)探究实验Ⅰ中停止产生气泡的原因。
提出假设:铁钉表面形成了含有+3价铁的氧化膜将铁钉覆盖。甲同学进行实验Ⅲ,得出假设成立的结论。
实验Ⅲ:将洗净的实验Ⅰ中无气泡产生时的铁钉置于试管中,加入滴有KSCN溶液的稀H2SO4,振荡,静置,溶液呈红色。
乙同学认为实验Ⅲ无法证实假设成立,其理由是未排除O2的干扰,请解释O2是如何干扰实验的:_____。
乙同学通过改进实验证实了假设成立。
(4)铁钉表面突然产生大量气泡的可能原因是Fe2+迅速被H2O2氧化形成氧化膜,使聚集在铁钉表面的H2脱离铁钉表面。形成氧化膜(以Fe3O4计)的离子方程式是____。
(5)实验Ⅰ中周而往复的现象与铁钉表面氧化膜的生成和溶解密切相关,从反应的速率角度分析其原因:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:

已知:转化过程中的反应为2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。常温下Ksp[Cr(OH)3]=1×10-32。下列说法错误的是( )
Cr2O72-(aq)+H2O(l)。常温下Ksp[Cr(OH)3]=1×10-32。下列说法错误的是( )
A.反应①v正(CrO42-)=2v逆(Cr2O72-)时,反应处于平衡状态
B.反应②转移0.6mole-,则有0.2mol Cr2O72-被还原
C.除去废水中含铬离子的过程包括氧化还原反应和复分解反应
D.常温下,要使处理后废水中的c(Cr3+)降至1×10-5mol·L-1,反应③应调溶液pH=5
查看答案和解析>>
科目: 来源: 题型:
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势如图所示:
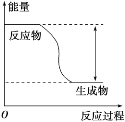
(1)该反应为_____(填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率加快,下列措施可行的是_____(填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_____(填“正”或“负”)极。铜片上的现象为_____,该极上发生的电极反应为_____,外电路中电子由_____移动。(填“正极向负极”或“负极向正极”)
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酸丁酯是重要的化工原料。实验室用乙酸、丁醇在浓硫酸作催化剂、加热条件下制备乙酸丁酯的装置示意图(加热和夹持装置已省略)和有关信息如下:

乙酸 | 正丁醇 | 乙酸丁酯 | |
熔点/℃ | 16.6 | -89.5 | -73.5 |
沸点/℃ | 117.9 | 117 | 126.0 |
密度/g·cm-3 | 1.1 | 0.80 | 0.88 |
下列说法正确的是( )
A.加热一段时间后,发现烧瓶C中忘记加沸石,可打开瓶塞直接加入即可
B.装置B的作用是不断分离出乙酸丁酯,提高产率
C.装置A可以装配蒸馏装置的冷凝器,且冷凝水由a口进,b口出
D.乙酸丁酯中残留的乙酸和正丁醇可用饱和碳酸钠溶液除去
查看答案和解析>>
科目: 来源: 题型:
【题目】辉铜矿(主要成分是Cu2S)含铜量高,是最重要的炼铜矿石。请回答下列问题:
Ⅰ.已知:①2Cu2S(s)+3O2(g) ![]() 2Cu2O(s)+2SO2(g) ΔH=768.2kJ·mol1
2Cu2O(s)+2SO2(g) ΔH=768.2kJ·mol1
②Cu2S(s)+O2(g)![]() 2Cu(s)+SO2(g) ΔH=217.4 kJ·mol1
2Cu(s)+SO2(g) ΔH=217.4 kJ·mol1
(1)Cu2S与Cu2O反应生成Cu和SO2的热化学方程式为____________,该反应中Cu2O作_________(填“氧化剂”或“还原剂”)。
Ⅱ.Cu2O可催化二甲醚合成乙醇。
反应①:CH3OCH3(g)+CO(g)![]() CH3COOCH3(g) ΔH1
CH3COOCH3(g) ΔH1
反应②:CH3COOCH3(g)+2H2(g)![]() CH3OH(g)+C2H5OH(g) ΔH2
CH3OH(g)+C2H5OH(g) ΔH2
(2)压强为p kPa时,同一体系中发生反应①和反应②,温度对二甲醚(CH3OCH3)和乙酸甲酯(CH3COOCH3)平衡转化率的影响如图1所示,则ΔH1______0(填“>”或“<”,下同)、ΔH2______0。温度对平衡体系中乙酸甲酯的百分含量和乙醇的百分含量的影响如图2所示。在300~600 K范围内,乙酸甲酯的百分含量逐渐增大,而乙醇的百分含量逐渐减小的原因是____________。
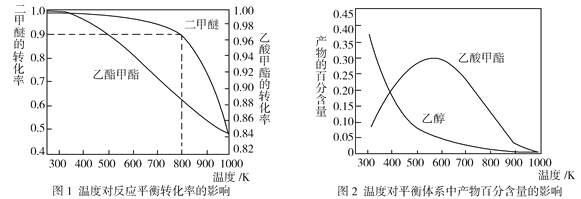
(3)若压强为p kPa、温度为800 K时,向2 L恒容密闭容器中充入1 mol CH3OCH3和1 mol CO发生反应①,2min时达到平衡,则前2min内CH3COOCH3的平均生成速率为_________,该条件下平衡常数K=_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化钪(Sc2O3)在合金、电光源、催化剂、激活剂和陶瓷等领域有广泛的应用,利用钪精矿为原料(主要成分为Sc2O3,还含有Fe2O3、MnO等杂质)生产氧化钪的一种工艺流程如下:

(1)“酸溶”步骤中,钪的浸出率结果如图所示。由图可知,为使钪的浸出率达90%左右,所采用的生产条件为___________________。

(2)加入氨水调节pH=3,过滤,滤渣主要成分是_____________;若再向滤液加入氨水调节pH=6,滤液中 Sc3+能否沉淀完全(离子浓度小于105 mol/L)?______________(列式计算并作判断)。(25℃时,Ksp[Mn(OH)2]=1.9×1013、Ksp[Fe(OH)3]=2.6×1039,Ksp[Sc(OH)3]=9.0×1031)
(3)已知钪与铝类似,其氢氧化物具有两性。反萃取步骤中,加入NaOH使溶液呈碱性,碱性条件下双氧水可以氧化锰离子生成滤渣,写出该反应的离子方程式______________。
(4)“沉钪”前先加入稀盐酸调节溶液至酸性,然后用草酸“沉钪”。25℃时pH=2的草酸溶液中![]() =_________________________。写出“沉钪”得到草酸钪(难溶于稀酸)的离子方程式___________________[25℃时,草酸电离平衡常数为Ka1=5.0×102,Ka2=5.4×105]。
=_________________________。写出“沉钪”得到草酸钪(难溶于稀酸)的离子方程式___________________[25℃时,草酸电离平衡常数为Ka1=5.0×102,Ka2=5.4×105]。
(5)草酸钪“灼烧”的化学方程式为_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、Q、R为原子序数依次增大的短周期元素。25℃时,其最高价氧化物的水化物溶液(浓度均为0.001mol·L-1)的pH和原子半径的关系如图所示。下列说法中正确的是( )
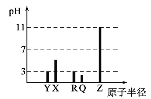
A.Y和Z的简单离子半径:Y<Z
B.R、Q的气态氢化物的稳定性:R>Q
C.R的最高价氧化物对应水化物的化学式为HRO3
D.上述五种元素中有两种元素是金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com