运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(1)硫酸生产中,SO
2催化氧化生成SO
3:2SO
2(g)+O
2(g)?2SO
3(g),混合体系中SO
3的质量分数和温度的关系如图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
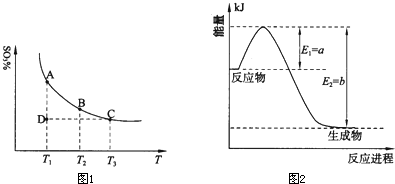
①2SO
2(g)+O
2(g)?2SO
3(g)的△H
<
<
0(选填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡
向左
向左
移动(选填“向左”、“向右”或“不”);
②若温度为T
1、T
2,反应的平衡常数分别为K
1、K
2,则K
1>
>
K
2;若反应进行到状态D时,v
正>
>
v
逆(选填“>”、“<”或“=”).
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①图2是一定的温度和压强下N
2和H
2反应生成1mol NH
3过程中能量变化示意图,请写出合成氨的热化学反应方程式:
N2(g)+3H2(g)?2NH3(g);
N2(g)+3H2(g)?2NH3(g);
、
△H=2(a-b)kJ?mol-1
△H=2(a-b)kJ?mol-1
.(△H的数值用含字母a、b的代数式表示,不必注明反应条件)
②氨气溶于水得到氨水.在25℃下,将xmol?L
-1的氨水与ymol?L
-1的盐酸等体积混合,所得溶液呈中性.则x
>
>
y,所得溶液中c(NH
4+)
=
=
C(Cl
-)(选填“>”、“<”或“=”);用含x和y的代数式表示出一水合氨的电离平衡常数
.
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在.在25℃下,向0.1mol?L
-1的NaCl溶液中逐滴加入适量的0.1mol?L
-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol?L
-1的NaI溶液,看到的现象是
白色沉淀转化为黄色沉淀
白色沉淀转化为黄色沉淀
,产生该现象的原因是(用离子方程式表示)
AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)
AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)
.(已知25℃时K
sp[AgCl]=1.0×10
-10 mol
2?L
-2,Ksp[AgI]=1.5×10
-16mol
2?L
-2)