
科目: 来源: 题型:
【题目】
近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl) ∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
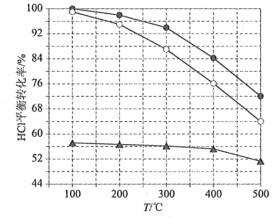
可知反应平衡常数K(300℃)____________K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400℃)=____________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是____________。
(2)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=83 kJ·mol-1
Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol-1。
(3)在一定温度的条件下,进一步提高HCI的转化率的方法是______________。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
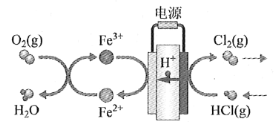
负极区发生的反应有____________________(写反应方程式)。电路中转移1 mol电子,需消耗氧气__________L(标准状况)
查看答案和解析>>
科目: 来源: 题型:
【题目】关于如图所示的原电池,下列说法正确的是
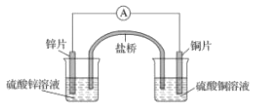
A.电子从锌电极通过电流表流向铜电极
B.盐桥中的阴离子向硫酸铜溶液中迁移
C.取出盐桥后,电流表仍会偏转,铜电极在反应前后质量不变
D.锌电极发生氧化反应;铜电极发生还原反应,其电极反应是2H++2e-=H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室欲用Na2SO4·10H2O固体来配制100mL0.2mol/L的Na2SO4溶液,试回答下列各题:
(1)需要用托盘天平称量__Na2SO4·10H2O固体;
(2)下列仪器中,不需要用到的是(填序号)___。
①漏斗 ②180mL容量瓶 ③烧杯 ④玻璃棒 ⑤药匙 ⑥托盘天平 ⑦冷凝管
若要实施配制,除上述仪器外,尚缺的玻璃仪器是__;
(3)容量瓶上除有刻度线外还应标有_,在使用前必须先__;
(4)配制过程有以下操作:
①称量 ②移液 ③冷却 ④洗涤 ⑤定容 ⑥溶解 ⑦摇匀
其正确的操作顺序应是___(把序号填在括号内):
①→( )→( )→( )→( )→( )→⑦
(5)下列五项操作中会导致该实验所配制的溶液浓度偏低的有___(填序号);
①称量时,左物右码放反了
②未冷却到室温就将溶液转移到容量瓶并定容
③Na2SO410H2O在配制溶液前失去了部分的结晶水
④定容时观察液面的情况如图所示(俯视)
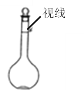
⑤定容后,把容量瓶反复摇匀后发现液面低于刻度线,便滴加几滴水至刻度处
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
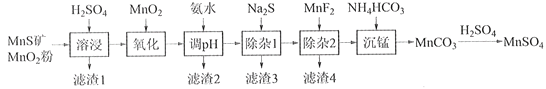
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMn![]() 时,z=___________。
时,z=___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制备溴苯的反应装置如图所示,关于实验操作或叙述错误的是 ( )
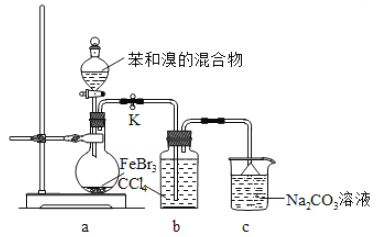
A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
C. 实验中装置b中的液体逐渐变为浅红色
D. 装置c中的碳酸钠溶液的作用是吸收溴化氢
查看答案和解析>>
科目: 来源: 题型:
【题目】如图的实验装置可用于研究SO2转化为SO3的转化率。已知:SO3的熔点是16.8℃,沸点是44.8℃处为SO2气体发生装置,C处为SO2与O2反应的装置。
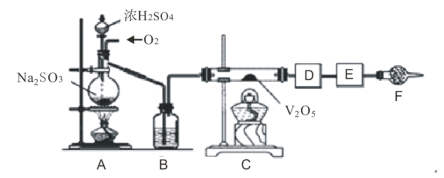
完成下列填空:
(1)A处的化学反应方程式为___,所用的硫酸一般为___(此处填98%的硫酸溶液、70%的硫酸溶液或30%的硫酸溶液)。
(2)根据实验需要,应该在D、E处连接合适的装置。请从图中选择,将所选装置的序号填入相应的空格,D:___,E:____。

(3)用12.6gNa2SO3粉末与足量浓硫酸进行此实验,当A处反应结束时,再继续通入一段时间![]() ,最后测得E处装置增重1.28gSO2,则此时SO2的转化率为____%。
,最后测得E处装置增重1.28gSO2,则此时SO2的转化率为____%。
(4)若Na2SO3变质,会影响到SO2的转化。现欲检验某Na2SO3样品是否变质,你的方法是___。
(5)以下各种尾气吸收装置中,适合于吸收该尾气,而且能防止倒吸的是___。

查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向![]() 溶液中逐滴滴入
溶液中逐滴滴入![]() 溶液,溶液的pH与
溶液,溶液的pH与![]() 溶液体积关系如图所示:(忽略溶液体积变化,且无气体产生)
溶液体积关系如图所示:(忽略溶液体积变化,且无气体产生)
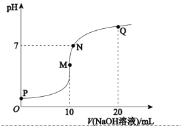
(1)用化学用语表示M点![]() 的原因__________。
的原因__________。
(2)![]() 四点中,水电离产生的
四点中,水电离产生的![]() 浓度最大的是______________点。
浓度最大的是______________点。
(3)下列关系中,正确的是________。
a P点![]()
b N点![]()
c Q点![]()
d ![]() 溶液中
溶液中![]() 小于
小于![]() 溶液中
溶液中![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验现象与实验操作不相匹配的是( )
实验操作 | 实验现象 | |
A | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
B | 向盛有高锰酸钾酸性溶液的试管中通入足 量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含![]() 等)制备
等)制备![]() 的流程如图所示。
的流程如图所示。

已知:Ⅰ在酸性条件下,![]() 能将
能将![]() 还原为
还原为![]()
Ⅱ. ![]() 的氧化性强于
的氧化性强于![]()
Ⅲ. 相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| 4.9 | 6.8 |
| 1.5 | 2.8 |
回答下列问题:
(1)向含铬废水中加入![]() 调节
调节![]() ,目的是__________。
,目的是__________。
(2)写出“氧化”步骤中反应的例子方程式_________。
(3)“加热”操作的目的是________。
(4)“酸化”过程中发生反应![]()
![]() 已知,“酸化”后溶液中
已知,“酸化”后溶液中![]() 则溶液中
则溶液中![]() =________。
=________。
(5)“结晶”后得到![]() 产品0.3000g,将其溶解后用稀
产品0.3000g,将其溶解后用稀![]() 酸化,再由浓度为
酸化,再由浓度为![]() 标准溶液滴定,滴定终点消耗标准溶液的体积为600mL,则产品的纯度为________。
标准溶液滴定,滴定终点消耗标准溶液的体积为600mL,则产品的纯度为________。
(6)在![]() 存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。
存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。
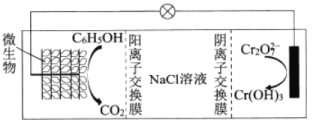
①负极的电极反应式为_________;
②处理过程中,需严格控制正极附近的pH,理由是_________
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A是一种常见金属,试根据图中转化关系,回答下列问题:
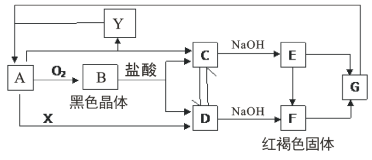
(1)写出B、G的化学式:B:___;G:___。
(2)检验D中阳离子的方法为___。
(3)保存C溶液时要加固体A的原因是___。
(4)写出E在空气中转化为F的化学方程式:___。
(5)取D的的溶液酸化后加入碘化钾淀粉溶液,产生的现象是___;相应的离子反应方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com