
科目: 来源: 题型:
【题目】在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),若使固体Mg(OH)2的量减少,而且c(Mg2+)不变,可采取的措施是:
Mg2+(aq)+2OH-(aq),若使固体Mg(OH)2的量减少,而且c(Mg2+)不变,可采取的措施是:
A. 加MgCl2B. 加H2OC. 加NaOHD. 加HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①过滤后所得沉淀为氢氧化铁
C.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
D.图中所有反应都不是氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是
![]() A. 向含有CaCO3沉淀的水中通入CO2 至沉淀恰好溶解,再向溶液中加入NaHCO3 饱
A. 向含有CaCO3沉淀的水中通入CO2 至沉淀恰好溶解,再向溶液中加入NaHCO3 饱
和溶液,又有CaCO3沉淀生成
B. 向Na2 CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2 CO3的物质的量之比为1:2.
C. 等质量的NaHCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D. 向Na2 CO3饱和溶液中通入CO2,有NaHCO3结晶析出
查看答案和解析>>
科目: 来源: 题型:
【题目】MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如图:
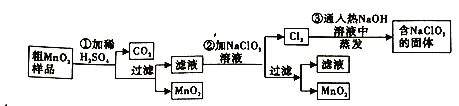
(1)第①步加稀H2SO4时,粗MnO2样品中的__(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是_Mn2++_ClO3-+_H2O=_MnO2↓+_Cl2↑+_H+。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、酒精灯、__、__,已知蒸发得到的固体中有NaClO3和NaOH,则一定还含有__(写化学式)
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7gMnO2,并收集到0.224LCO2(标准状况下),则在第②步反应中至少需要__molNaClO3。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上采用硫铁矿焙烧的烧渣(主要成分为Fe2O3、SiO2,不考虑其他杂质)制取绿矾(FeSO4·7H2O),流程如图:

(1)滤渣Ⅰ的主要成分是___(填化学式)。
(2)还原时,试剂X若选用SO2,其反应后生成的阴离子是(填化学式)___。
(3)从还原后的溶液中得到产品,应进行的操作是___、___、过滤、洗涤、干燥。
(4)绿矾(FeSO4·7H2O)在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤a:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成250.00mL溶液;
步骤b:取上述溶液25.00mL于锥形瓶中,加入少量稀硫酸酸化后,逐渐滴加0.1000mol/L的KMnO4溶液,至恰好完全反应,记录消耗的KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应),发生的反应为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
步骤c:重复“步骤b”2~3次,平均消耗KMnO4溶液20.00mL。该补血剂中亚铁离子的含量为___mg/片。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于实验操作的叙述中正确的是( )
①从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶 ②可燃性气体点燃之前必须验纯
③用胶头滴管向试管中滴加液体,一定要将胶头滴管伸入试管中
④用托盘天平称量固体药品时,应左物右码
⑤配制浓硫酸与蒸馏水的混合液时,应将浓硫酸慢慢加到蒸馏水中并及时揽拌和冷却
⑥选用![]() 量筒量取
量筒量取![]() 稀硫酸
稀硫酸
A.①③④⑤B.①③④⑥
C.②④⑤D.以上答案均不正确
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Cl2+2I=2C1-+I2为验证Fe3+、I2氧化性的相对强弱。某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
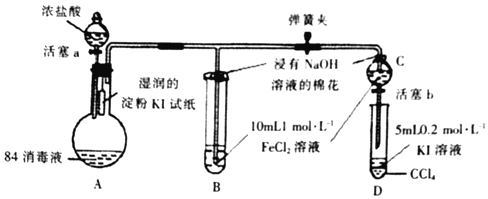
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,关闭活塞a。
Ⅳ.打开活塞b,将C中的溶液滴入D中,关闭活塞b,取下D振荡、静置。
请回答下列问题:
(1)A中产生黄绿色气体,写出A中发生反应的离子方程式___。
(2)验证氯气的氧化性强于碘单质的实验现象是___。
(3)B中通入氯气溶液变黄的离子方程式是;再向B中滴加KSCN溶液,溶液变红的离子方程式是___。
(4)C中的溶液滴入D中,振荡、静置,若产生现象,则说明Fe3+的氧化性强于碘单质,对应反应的离子方程式是___。有人认为这个实验设计存在缺陷,其理由是___。
(5)浸有氢氧化钠溶液的棉花作用是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物HIn在水溶液中因存在以下电离平衡HIn(aq,红色) ![]() H+(aq)+ In-(aq,黄色)故可作酸碱指示剂。浓度为0.02mol/L的下列溶液:① 盐酸 ② 石灰水 ③ NaCl溶液 ④ NaHSO4溶液 ⑤ NaHCO3溶液 ⑥ 氨水,其中能使指示剂显红色的是
H+(aq)+ In-(aq,黄色)故可作酸碱指示剂。浓度为0.02mol/L的下列溶液:① 盐酸 ② 石灰水 ③ NaCl溶液 ④ NaHSO4溶液 ⑤ NaHCO3溶液 ⑥ 氨水,其中能使指示剂显红色的是
A. ④⑤B. ③⑤C. ①④D. ②⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如图所示(部分生成物已略去)。其中,A为黑色固体;C、D为金属单质,且D为红色;H为红棕色粉末,常用作红色油漆和涂料。
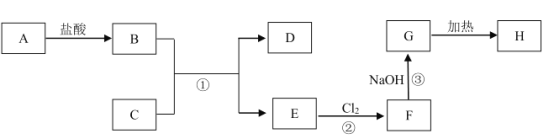
(1)写出物质H的化学式:___。
(2)写出下列反应的离子方程式:反应②___,反应③___。
(3)向E溶液中滴入NaOH溶液时,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色。写出沉淀由白色变成红褐色的化学方程式:___。
(4)印刷电路板是由高分子材料和金属D复合而成的。刻制印刷电路时,要用过量的F溶液作为“腐蚀液”,其在刻制过程中作___(填“氧化”或“还原”)剂,写出该反应的离子方程式:___。
(5)某同学通过实验实现了反应F→E的转化,为了检验F是否完全转化为E,设计如下实验方案:取少量F于试管中,加水溶解,并滴加KSCN溶液,再向其中加入粉末C,振荡。当观察到___现象时,证明F完全转化为E。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组的同学在实验室利用下列装置进行实验。

请回答下列问题:
(1)甲同学用A装置制备NO2气体,上述装置中可用于收集NO2气体的是___(填字母),A中发生反应的离子方程式为___。
(2)乙同学用图中的装置A进行铜与浓硫酸反应制取SO2气体,装置A中还缺少的仪器名称是___,该反应的化学方程式为___;实验所产生的SO2尾气选用装置___(填字母)来吸收。
(3)丙同学用装置B制取氨气,发生反应的化学方程式是___;为了检验集气瓶中氨气是否集满,可将湿润的红色石蕊试纸置于导管口,若___,则证明已收集满;若将一端蘸有浓盐酸的玻璃棒接近导管口,观察到的现象是___,该反应的化学方程式为___。
(4)丙同学在实验室中模拟氨的催化氧化反应,该反应中,当生成标准状况下11.2LNO时,被氧化的物质的质量是___g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com