
科目: 来源: 题型:
【题目】盐酸罗匹尼罗用于治疗帕金森症,治疗中度到重度的不宁腿(多动腿)综合症,罗匹尼罗(H)的一种合成路线如图所示。

已知:①路线中Ph-代表![]() ,Ac-代表CH3COO-;
,Ac-代表CH3COO-;
②RCOOR’![]() R’OH
R’OH
请回答下列问题:
(1)D中含氧官能团的名称为___。
(2)E的分子式为___;一定条件下,1molE最多与___molH2发生加成反应(不考虑开环加成)。
(3)G→H的反应类型为___。
(4)A→B的化学方程式为___。
(5)同时满足下列条件的A的同分异构体有___种(不考虑立体异构);
①含苯环②遇FeCl3溶液显紫色③有两个取代基
其中核磁共振氢谱为5组峰且峰面积之比为4:2:2:1:1的结构简式为___。
(6)参照上述合成路线,请设计以![]() 为起始原料制备
为起始原料制备![]() 的合成路线为___(其他无机试剂任选)。
的合成路线为___(其他无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
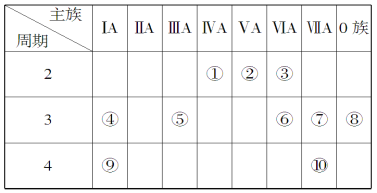
(1)元素⑦的名称为______,在周期表中的位置______________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是_______,碱性最强的化合物的电子式是__________。
(3)用电子式表示元素④和⑥的化合物的形成过程:____________,该化合物属于______(填“共价”或“离子”)化合物。
(4)写出一种由上述元素组成的既有离子键又有共价键的物质的化学式______。
(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是_________(用离子符号表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】无水AlCl3易升华,可用作有机合成的催化剂等.工业上用铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下:

(1)氧化炉中Al2O3、Cl2和C反应的化学方程式______.
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式______.
(3)为了测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25g无水AlCl3样品,溶于过量的NaOH溶液中,过滤出沉淀物,再洗涤、灼烧、冷却、称重、得其质量为0.32g。
①写出上述测定过程中涉及的离子方程式:______、__________。
②AlCl3产品的纯度为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】教材插图是对教材内容高度概括的体现,也是为说明、理解、深化文字内容服务的。请回答下列问题:
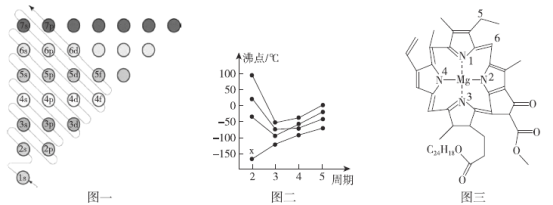
(1)图一为构造原理示意图,其含义是从H原子开始随着原子核电荷数递增,原子核每增加一个质子,核外便增加一个电子,电子大多按如图顺序填充。第四周期中,基态4s能级半充满的元素有___种,其中原子序数最大的基态原子的外围电子排布式为___。
(2)图二中,每条折线代表周期表中IVA-VIIA某一族元素简单氢化物的沸点变化,其他三条折线与x所在折线变化趋势不完全相同的原因为___;与x点对应的简单氢化物互为等电子体的离子为___(写一种)。
(3)图三为卟啉配合物叶绿素的结构示意图,1号N原子和3号N原子与Mg2+形成的化学键类型为___;5号C原子和6号C原子的杂化方式分别为___、___;该分子中所含非金属元素的电负性由小到大的顺序为___。
(4)从石墨晶体结构示意图中截取石墨的晶胞如图所示,设阿伏加德罗常数为NA,已知sin60°=![]() ),石墨晶体的密度为___g·cm-3(列出计算式)。
),石墨晶体的密度为___g·cm-3(列出计算式)。

查看答案和解析>>
科目: 来源: 题型:
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥、纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
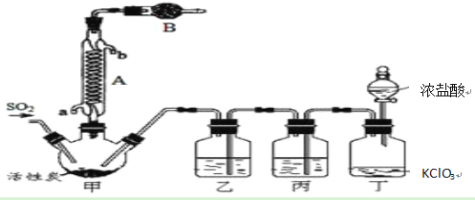
(1)仪器A冷却水的进水口为________(填“a”或“b”)。
(2)仪器B中盛放的药品是________,其目的是________________________。
(3)实验时,装置丁中发生反应的离子方程式为______________________________,当生成6.72L的氯气(标况下),转移电子的物质的量为________。
(4)装置丙中盛放的试剂是________,若缺少装置乙,对实验造成的影响是_______________。
(5)少量硫酰氯也可用液态氯磺酸(ClSO3H)低温催化分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 +SO2Cl2,从分解产物中分离出硫酰氯的操作是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向X溶液中加入Y试剂,产生沉淀或气体如图,与所述情形几乎完全相符的是( )

A. 向HCl和AlCl3的混合液滴加NaOH溶液 B. 向NH4Al(SO4)2 溶液滴加 Ba(OH)2溶液
C. 向NaOH和Ca(OH)2混合液中通入CO2 D. 向NaOH和Na2CO3混合液滴加稀HCl溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】铜的多种化合物在生产生活中都有广泛用途。请回答下列问题:
(1)Cu2O和CuO是铜的两种氧化物,可互相转化。已知:
i.2Cu2O(s)+O2(g)=4CuO(s) △H=-292.0kJ·mol-1
ii.C(s)+2CuO(s)=Cu2O(s)+CO(g) △H=+35.5kJ·mol-1
若CO的燃烧热为283.0kJ·mol-1,则C(s)的燃烧热为___。
(2)Cu2O和CuO常用作催化剂。
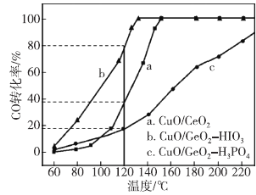
①质子交换膜燃料电池(PEMFC)的燃料气中除含有H2外还含有少量的CO和CO2,其中CO是PEMFC催化剂的严重毒化剂,可用CuO/CeO2作催化剂优先氧化脱除CO。160℃、用CuO/CeO2作催化剂时,氧化CO的化学方程式为___;分别用HIO3和H3PO4对CuO/CeO2进行处理,在一定条件下,利用不同催化剂进行CO氧化的对比实验,得如图曲线,其中催化剂___ (填“b”或“c”)催化性能最好;120℃使用催化剂b进行氧化,若燃料气中CO的体积分数为0.71%,气体流速为2000mL·h-1,则1h后,CO体积为___mL。
②在Cu2O催化作用下合成CH3OH,反应如下:CO(g)+2H2(g)![]() CH3OH(g) △H=-90.0kJ·mol-1,有利于提高该反应CO的平衡转化率的条件是___(填标号)。
CH3OH(g) △H=-90.0kJ·mol-1,有利于提高该反应CO的平衡转化率的条件是___(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
T℃时,将CO和H2按一定比例混合后投入容积为2L的恒容密闭容器中,CO的起始浓度为1.0mol·L-1,平衡时,测得体系中,n(H2)=1.4mol,n(CH3OH)=1.7mol,反应达到平衡时CO的转化率为___,若反应达到平衡状态后,保持其他条件不变,再充入0.2molCO和0.2molCH3OH,平衡向___(填“正”或“逆”)反应方向移动,理由是___。
(3)CuS呈黑色,是最难溶的物质之一,由于它的难溶性使得一些看似不可能的反应可以发生。向0.01mol·L-1CuSO4溶液中,持续通入H2S维持饱和(H2S饱和浓度为0.1mol·L-1),发生反应:H2S(aq)+Cu2+(aq)![]() CuS(s)+2H+(aq),该反应的化学平衡常数K为___(保留2位有效数字)。已知:Ka1(H2S)=1.1×10-7,Ka2(H2S)=1.3×10-13,Ksp(CuS)=6.3×10-36。
CuS(s)+2H+(aq),该反应的化学平衡常数K为___(保留2位有效数字)。已知:Ka1(H2S)=1.1×10-7,Ka2(H2S)=1.3×10-13,Ksp(CuS)=6.3×10-36。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸锌是制造锌钡白和锌盐的主要原料,也可用于湿法电解制锌,如图为由锌灰制ZnSO4·7H2O晶体的工艺流程。
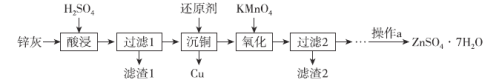
已知:
①锌灰的主要成分为ZnO,还含有CuO、PbO、MnO和FeO;
②“滤渣2”的主要成分为Fe(OH)3和MnO(OH)2。
请回答下列问题:
(1)MnO(OH)2中Mn元素的化合价为___。
(2)为提高浸出效率,锌灰在“酸浸”前可采取的措施有___;“酸浸”时,若硫酸浓度过高,可能发生副反应的化学方程式为___。
(3)“滤渣1”的主要成分为___。
(4)“氧化”时,需控制溶液的pH=5.1,Fe2+被氧化的离子方程式为___。
(5)操作a为___、过滤、洗涤、干燥。
(6)ZnSO4·7H2O产品的纯度可用配位滴定法测定。
准确称取一定量的ZnSO4·7H2O晶体加入250mL的锥形瓶中,加水约20mL,再加入2-3滴5%的二甲酚橙作指示剂、约5mL六亚甲基四胺缓冲溶液,摇匀。用已标定的0.0160mol·L-1EDTA溶液滴定,滴定至溶液由红紫色变成亮黄色,即为终点(ZnSO4·7H2O与EDTA按物质的量之比1:1反应)。实验数据如下表:

ZnSO4·7H2O产品的纯度为___ (保留2位有效数字)。
(7)工业上采用惰性电极作阳极电解ZnSO4溶液可实现湿法炼锌,电解过程中的离子方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,wg某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加wg。在①H2;②CO;③CO和H2的混合物 ④HCHO;⑤CH3COOH;⑥HO-CH2-CH2-OH中,符合题意的是
A. 均不符合 B. 只有①②③ C. 只有④⑤ D. 全部符合
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
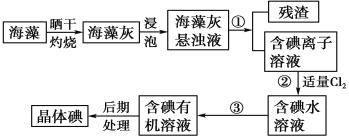
(1)实验室焙烧海带,需要下列仪器中的________(填序号)。
a 试管 b 烧杯 c 坩埚 d 泥三角 e 铁三脚架 f 酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①__________,③________。
(3)提取碘的过程中,可选择的有机试剂是(_______)
A 甲苯、酒精 B 四氯化碳、苯
C 汽油、乙酸 D 汽油、甘油
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有__________、__________。
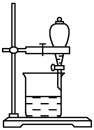
(5)小组用CCl4萃取碘水中的碘,在右图的分液漏斗中,下层液体呈__________色;
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:

①____________________;
②_______________________________;
③____________________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com