
科目: 来源: 题型:
【题目】阿昔洛韦[化学名称:9-(2-羟乙氧甲基)鸟嘌呤]是抗非典型肺炎(SARS)的指定药物之一,其结构如图所示,有关阿昔洛韦的结构及性质的叙述中正确的是

①1 mol阿昔洛韦在催化剂作用下,最多可与5molH2发生加成反应;②属于芳香烃;③是一种易溶于水的醇;④可以被催化氧化;⑤不能使溴水褪色;⑥可以燃烧;
A. ①②③④⑥B. ②④⑤⑥C. ③④⑤⑥D. ④⑥
查看答案和解析>>
科目: 来源: 题型:
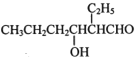
【题目】辛烯醛是一种重要的有机合成中间体,沸点为177℃,密度为0.848 g·cm-3,不溶于水。实验室采用正丁醛制各少量辛烯醛,反应原理为:
CH3CH2CH2CHO![]()
![]()
![]()
实验步骤如下:
步骤Ⅰ:向三颈烧瓶中加入6.3 mL 2% NaOH溶液,在充分搅拌下,从恒压滴液漏斗慢慢滴入5mL正丁醛。
步骤Ⅱ:充分反应后,将反应液倒入如图仪器中,分去碱液,将有机相用蒸馏水洗至中性。
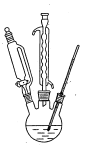
步骤Ⅲ:经洗涤的有机相加入适量无水硫酸钠固体,放置一段时间后过滤。
步骤Ⅳ:减压蒸馏有机相,收集60~70℃/1.33~4.00kPa的馏分。
(l)步骤Ⅰ中的反应需在80℃条件下进行,适宜的加热方式为___ 。使用冷凝管的目的是 _______。
(2)步骤Ⅱ中所用仪器的名称为_____ 。碱液在仪器中处于_____(填“上层”或“下层”),如何判断有机相已经洗至中性:______。
(3)步骤Ⅲ中加入无水硫酸钠固体的作用是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一体积2L的密闭容器中加入反应物N2、H2,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
物质的量/ mol 时间/min | n(N2) | n(H2) | n(NH3) |
0 | 1.0 | 1.2 | 0 |
2 | 0.9 | ||
4 | 0.75 | ||
6 | 0.3 |
A. 0~2 min内,NH3的反应速率为0.1 mol·Lˉ1·minˉ1
B. 2 min时, H2的物质的量0.3 mol
C. 4 min时,反应已达到平衡状态,此时正、逆反应的速率都为0
D. 4~6 min内,容器内气体分子的总物质的量不变
查看答案和解析>>
科目: 来源: 题型:
【题目】甲酸香叶酯是一种食品香料,可以由香叶醇与甲酸发生酯化反应制得。下列说法正确的是( )

A. 香叶醇的分子式为C11H18O
B. 香叶醇在浓硫酸、加热条件下可发生消去反应
C. 香叶醇与CH2=CHCH=CHCH2OH互为同系物
D. 香叶醇与甲酸香叶酯均不能发生银镜反应
查看答案和解析>>
科目: 来源: 题型:
【题目】锂离子电池己被广泛用作便携式电源。正极材料为LiCoO2、LiFePO4等,负极材料一般为石墨碳,以溶有LiPF6、LiBF4等的碳酸二乙酯(DEC)作电解液。
(1)Fe2+基态核外电子排布式为 ________。
(2)PO43-的空间构型为 ________ (用文字描述)。
(3)![]() 中
中![]() 的配位数为6,该配合物中的配位原子为 _____。
的配位数为6,该配合物中的配位原子为 _____。
(4)碳酸二乙酯(DEC)的分子结构如图所示,分子中碳原子的轨道杂化类型为_____,1mol碳酸二乙酯(DEC)中含有σ键的数目为_____。
![]()
(5)氮化锂是一种新型无机贮氢材料,其晶胞结构如图所示,该晶体的化学式为_______。
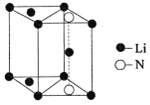
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法不正确的是( )
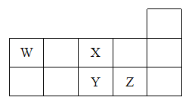
A.Z、Y、W的最高价氧化物的水化物的酸性依次减弱
B.Z、Y、X的原子半径依次减小,非金属性依次减弱
C.气态氢化物的稳定性:H2X>H2Y
D.W的位置是第二周期第ⅣA族
查看答案和解析>>
科目: 来源: 题型:
【题目】H2O2的制取及其在污水处理方面的应用是当前科学研究的热点。
(1)“氧阴极还原法”制取H2O2的原理如题图所示:
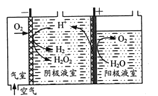
阴极表面发生的电极反应有:
Ⅰ.2H++O2+2e-=H2O2
Ⅱ. H2O2+2H++ 2e-=2H2O
Ⅲ. 2H+ +2e-=H2↑
①写出阳极表面的电极反应式:___。
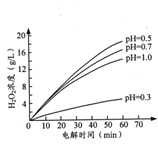
②其他条件相同时,不同初始pH(均小于2)条件下,H2O2浓度随电解时间的变化如图所示,c(H+)过大或过小均不利于H2O2制取,原因是_______。
(2)存碱性条件下,H2O2的一种催化分解机理如下:
H2O2(aq)+Mn2+(aq)=·OH(aq)+Mn3+(aq)+OH-(aq) H=akJ/mol
H2O2(aq)+ Mn3+(aq) +2OH-(aq)= Mn2+(aq) +·O2-(aq) +2H2O(l) H=bkJ/mol
·OH(aq) +·O2-(aq)=O2(g) +OH-(aq) H=ckJ/mol
2H2O2(aq)= 2H2O(l)+O2(g) △H=_______ 。该反应的催化剂为 ____。
(3)H2O2、O3在水中可形成具有超强氧化能力的羟基自由基(·OH),可有效去除废水中的次磷酸根离子(H2PO2-)。
①弱碱性条件下·OH将H2PO2-氧化成PO43-,理论上l.7g·OH可处理含0.001mol/L H2PO2-的模拟废水的体积为______。
②为比较不同投料方式下含H2PO2-模拟废水的处理效果,向两份等体积废水样品中加入等量H2O2和O3,其中一份再加入FeSO4。反应相同时间,实验结果如图所示:
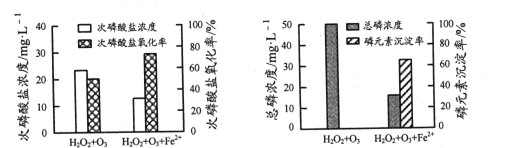
添加FeSO4后,次磷酸盐氧化率、磷元素沉淀率均显著提高,原因是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,它们对应的信息如下:

请根据表中信息填写:
(1)Z元素在周期表中的位置___________,Z的单质和氧化铁反应可用于野外焊接钢轨,该反应属于___________(填“吸热”或“放热”)反应。
(2)XW2的电子式____________。
(3)由X、Y、W三种元素按原子个数之比1:1:1组成一种分子,相对分子质量为116。已知该分子中各原子均达到8电子稳定结构,且不含双键。请写出该分子的结构式________。
(4)X、Y的最简单氢化物中,更稳定的是___________。(填化学式)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关叙述正确的是( )
A. 在![]() 分子中含有1个手性C原子
分子中含有1个手性C原子
B. 氢键是一种特殊化学键,它广泛地存在于自然界中
C. 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子
D. 含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越大
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以含银废液{主要含[Ag(NH3)2]+、[Ag(S2O3)2]3-}为原料制取硝酸银晶体,其实验流程如下:
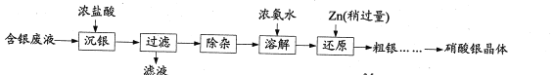
已知:①“沉银”所得AgCl中含有少量PbCl2、Ag2S。
②Zn2+在浓氨水中以[Zn(NH3)4]2+形式存在。
③PbCl2、AgNO3的溶解度曲线如图所示:
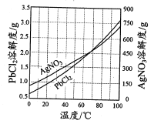
(1)“滤液”中的主要阳离子为___(填化学式)。
(2)“除杂”分为两步:先除去PbCl2,再除去Ag2S。
①在不同温度下,AgCl、Ag2S均难溶于水。 除去PbCl2的操作为______,热水洗涤。
②向热水洗涤所得固体中加入浓硝酸和稀盐酸,边加热边充分搅拌,使Ag2S转变为AgCl。加入浓硝酸的目的是_______。
(3)室温下,可逆反应AgCl+2NH3·H2O[Ag(NH3)2]++Cl-+2H2O的平衡常数K=___。{Ksp(AgCl)= 1.8×10-10,Ag++2NH3·H2O[Ag(NH3)2]++2H2O的平衡常数为1.1×107}
(4)“还原”过程中发生反应的离子方程式为_____ 。
(5)粗银经水洗后,经多步处理可制备硝酸银晶体。请补充完整由以水洗后粗银为原料,制备硝酸银晶体的实验方案:________,过滤,________,将产生的气体和空气混合后通入NaOH溶液进行尾气处理,将所得AgNO3溶液_______,过滤,将所得晶体置于烘箱 (120℃)干燥,密封包装。(实验中须使用的试剂:稀硫酸、稀硝酸、BaC12溶液)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com