
科目: 来源: 题型:
【题目】维拉帕米(又名异搏定)是治疗心绞痛和原发性高血压的药物,合成路线中某一步骤如图所示,下列说法中正确的是
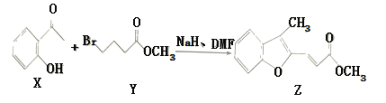
A. Y的分子式为C5H11O2 Br
B. 含苯环和羧基的ⅹ的同分异构体有4种
C. 可以用酸性高锰酸钾溶液鉴别X和Z
D. 1mol Z最多可与6mol H2发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】将32.0 gCu投入50mL 12moL/L的浓硝酸中,充分反应后,收集到4.48L(标准状况)NO和NO2的混合气体。
(1)被还原硝酸的物质的量是_________mol。
(2)判断32.0gCu和50mL 12moL/L的硝酸反应后有剩余的是______________,剩余的物质物质的量为____________________,生成的NO气体体积为(标况下)_________________。
(3)如果往反应后的体系内再加入100mL2mol/L的稀硫酸,充分反应后又有气体逸出。写出反应的离子方程式并用单线桥法表示电子转移的方向和数目 _______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组用下列装置制备溴苯,下列说法错误的是

A. 装置A中长玻璃导管仅起冷凝回流作用,装置B中的实验现象是CCl4由无色变橙色
B. 若装置B后连接装置C,装置C中生成淡黄色沉淀,可证明装置A中发生取代反应
C. 若装置B后连接装置D,则装置D的作用是吸收尾气
D. 向反应后的装置A中加入NaOH溶液,振荡静置,下层为无色油状液体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 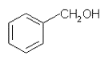 与
与![]() 含有相同的官能团,互为同系物
含有相同的官能团,互为同系物
B.  属于醛类,官能团为-CHO
属于醛类,官能团为-CHO
C. ![]() 的名称为:2-乙基-1-丁烯
的名称为:2-乙基-1-丁烯
D. ![]() 的名称为:2-甲基-1,3-二丁烯
的名称为:2-甲基-1,3-二丁烯
查看答案和解析>>
科目: 来源: 题型:
【题目】已知碳碳单键可以旋转,结构简式为 ![]() 的烃,下列说法中正确的是
的烃,下列说法中正确的是
A. 分子中最多有6个碳原子处于同一直线上
B. 该烃苯环上的一氯代物有3种
C. 分子中至少有12个碳原子处于同一平面上
D. 该烃属于苯的同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】着色剂为使食品着色的物质,可增加对食品的嗜好及刺激食欲。红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如图所示。

下列说法正确的是
A. 红斑素和红曲素都存在2个手性碳原子
B. 一定条件下红斑素和红曲素都能发生加聚和自身的缩聚反应
C. 红斑素中含有醚键、羰基、酯键这三种含氧官能团
D. 1 mol红曲素最多能与6molH2发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:
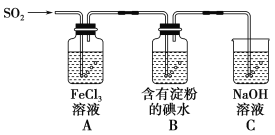
(1)SO2气体和Fe3+反应的氧化产物、还原产物分别是________、________
(2)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与浓H2SO4共热
(3)装置C的作用是__________________________________________________。
(4)装置B中反应的离子方程式_________________________________________________。
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入NaOH溶液,产生白色沉淀,并迅速转为灰绿,最后呈红褐色。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是方案_____,原因是__________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】已知TNT为烈性炸药,其爆炸时的方程式为:TNT +21O2![]() 28CO2+10H2O+6N2,下列有关该反应的说法正确的是( )
28CO2+10H2O+6N2,下列有关该反应的说法正确的是( )
A. TNT在反应中只做还原剂
B. TNT中的N元素化合价为+5价
C. 方程式中TNT前的化学计量数为2
D. 当1molTNT参加反应时,转移的电子数为30×6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl36H2O能否反应产生Cl2。
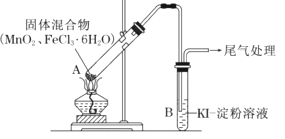
资料:FeCl3是一种共价化合物,熔点306℃,沸点315℃。
ⅰ.实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
ⅱ.分析现象的成因:
(1)现象i中的白雾是______,用化学方程式和必要的文字说明白雾的形成原因是______。
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.直接加热FeCl3·6H2O,产生白雾和黄色气体。
b.将现象ii和a中的黄色气体通入KSCN溶液,溶液均变红。通过该实验说明现象ii中黄色气体含有______。
(3)除了氯气可使B中溶液变蓝外,该小组还提出其他两种可能的原因:
可能原因①:实验b检出的气体使之变蓝;
反应的离子方程式是______。
可能原因②:______;
反应的离子方程式是______。
(4)为进一步确认黄色气体中是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1 | 在A、B间增加盛有某种试剂的洗气瓶C | B中溶液变为蓝色 |
方案2 | 将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+ | B中溶液呈浅橙红色;未检出Fe2+ |
①方案1的C中盛放的试剂是______,从化学平衡原理的角度加以解释______。
②方案2中检验Fe2+的最佳试剂是______,若存在Fe2+,则现象是______。
③综合方案1、2的现象,说明方案2中选择NaBr溶液的依据是______。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年,元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。
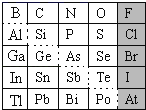
(1)根据元素周期律,推断:
①H3AsO4、H2SeO4的酸性强弱:H3AsO4___H2SeO4(填“>”、“<”或“=”)。
②氢化物的还原性:H2O___H2S(填“>”、“<”或“=”)。
(2)可在图中分界线(虚线部分)附近寻找___(填序号)。
A.优良的催化剂B.半导体材料C.合金材料D.农药
(3)①Se2Cl2常用作分析试剂,其电子式为___。
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。下列说法正确的是___(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(4)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)。
实验步骤 | 实验现象与结论 |
在试管中加入___,再加入___,将生成气体通过___洗气后,通入___; | 现象:___;结论:非金属性C>Si |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com