
科目: 来源: 题型:
【题目】如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
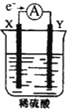
A.外电路的电流方向为:X→外电路→Y
B.若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。
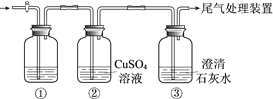
实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A. ③中白色浑浊是CaCO3
B. ②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C. 实验Ⅰ①中CO2过量发生的反应是:CO2+H2O+ S2== CO32+ H2S
D. 由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱
查看答案和解析>>
科目: 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中,2molNO和1molO2反应后分子总数为2NA
B.1mol铁在1mol氯气中燃烧,转移的电子数为3NA
C.在标准状况下,4.48L甲烷的氯代物分子含原子数目为NA
D.一定条件下,2.3gNa与O2完全反应生成3.6g产物时失去的电子数0.1NA
查看答案和解析>>
科目: 来源: 题型:
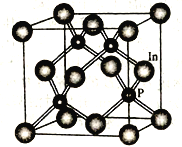
【题目】磷的单质及其化合物用途非常广泛。回答下列问题:
(1)基态磷原子价电子轨道表示式为______________________;磷的第一电离能比硫大,其原因是_____________________________________________。
(2)已知反应6P2H4==P4+ 8PH3↑。P2H4分子中磷原子杂化类型是________________;P4分子的几何构型是________________________。
(3)N和P同主族。
①NH3的沸点比PH3高,其原因是_________________________;NH3分子中键角比PH3分子中键角大,其原因是______________________________________________。
②氮原子间可形成氮氮双键或氮氮叁键,而磷原子之间难以形成双键或叁键。从原子结构角度分析,原因是___________________________________________。
(4)磷化铟是一种半导体材料,其晶胞如下图所示,晶胞参数为a nm。In 的配位数为_______________;与In原子间距离为![]() a nm 的In 原子有________个。
a nm 的In 原子有________个。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是
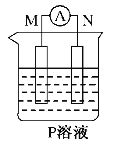
选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】2020年3月11日注射用西维来司他钠获得国家药监局批准上市,用于治疗新冠病毒等造成的急性肺损伤,化合物F是合成该药物的中间体,其合成路线如下:
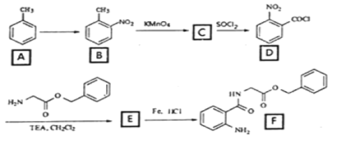
(1)E中官能团的名称是______;
(2)写出C的结构简式_______________;
(3)写出符合下列条件的B的一种同分异构体___________________;
①能发生水解反应且能发生银镜反应
②遇FeCl3溶液显蓝紫色
(4)反应A→B所需试剂及条件_________________;
(5)反应B→C的反应类型___________________;
(6)写出D→E的化学反应方程式_______________________;
(7)参考本题信息,写出由间二甲苯与NH2CH2CH制备下图有机物的合成线路_________(无机试剂任选) 。
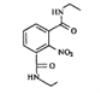
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇是重要的有机化工原料,也是优质的燃料,工业上可由乙烯水合法或发酵法生产。回答下列问题:
(1)乙烯水合法可分为两步
第一步:反应CH2=CH2+ HOSO3H(浓硫酸)→CH3CH2OSO3H(硫酸氢乙酯);
第二步:硫酸氢乙酯水解生成乙醇。
①第一步属于反应_______________(填反应类型)。
②第二步反应的化学方程式为_____________________________。
(2)发酵法制乙醇,植物秸秆(含50%纤维素)为原料经以下转化制得乙醇
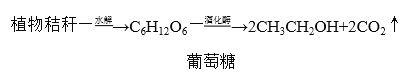
纤维素的化学式为________,现要制取4.6 吨乙醇,至少需要植物秸秆________吨。
(3)乙醇汽油是用90%的普通汽油与10%的燃料乙醇调和而成。乙醇汽油中乙醇是可再生能源,来源于________(填“乙烯水合法”或“发酵法”)。
(4)以乙醇为原料可制备某种高分子涂料,其转化关系如下图:

①有机物A的结构简式为___________。
②反应Ⅱ的化学方程式为___________。
③反应Ⅱ的反应类型为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A. 16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
B. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
C. pH=1的HCl溶液中,含有0.1NA个H+
D. 0.1mol苯乙烯分子中,含有碳碳双键的数目为0.4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用锂离子电池般需要体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。请回答下列问题:
(1)LiCoO2、LiFePO4 常用作锂离子电池的正极材料。基态Fe原子的价电子排布式为___基态Co原子核外电子的空间运动状态有_______种。
(2)PO43-的空间构型是______,写出与其互为等电子体的一种阴离子______,基态P原子的第一电离能为什么比基态S原子的第一电离能大:______。
(3)现有化学式为Co(NH3)5Cl3的配合物,1mol 该物质最多可以与2molAgNO3反应,则该配合物中钴的配位数为______, 配体中N的杂化方式为_____,1mol 该配合物中含δ键数目为______NA。
(4)FeO是离子晶体,其晶格能可通过下图的Bom-Haber循环计算得到。气态电中性基态原子获得一个电子变为气态一价负离子放出的能量叫做第一电子亲和能,由图可知O原子的第一电子亲和能为_____kJ·mol-1, FeO晶格能为_____kJ·mol-1。

(5)单质锂晶体的结构如下图,晶胞中锂的配位数为____,晶胞的空间利用率为____(用含有n的表达式即可),若晶胞边长为a pm, NA为阿伏加德罗常数,则金属锂的密度为_____ g cm-3。(写出计算式)

查看答案和解析>>
科目: 来源: 题型:
【题目】2019年厦门大学王野教授课题组在合成气(主要成分CO和H2)催化转化制乙醇方面实施可控接力催化,按照:合成气→甲醇→乙酸→乙醇的方式,成功实现乙醇的高选择性合成。
(1)已知:①H2(g)+![]() O2(g)=H2O(g) △H1=-285.8KJ/mol;②CO(g)+
O2(g)=H2O(g) △H1=-285.8KJ/mol;②CO(g)+![]() O2(g)=CO2(g) △H2=-283KJ/mol;③CH3OH(g)+
O2(g)=CO2(g) △H2=-283KJ/mol;③CH3OH(g)+![]() O2(g)= CO2(g)+2 H2O(l) △H3=-764.6 KJ/mol;
O2(g)= CO2(g)+2 H2O(l) △H3=-764.6 KJ/mol;
则工业上利用合成气制备甲醇的可逆反应热化学方程式为______________________;
(2)恒温恒容条件下,下列能说明合成气制甲醇的反应已达平衡状态的是_______;
A.单位时间内生成n mol CO的同时生成2n mol H2
B. v(H2)正= 2v(CH3OH)逆
C.容器内气体的密度保持不变
D.容器中气体的平均摩尔质量保持不变
(3)利用天然气制取合成气的原理为: CO2(g)+CH4(g)= 2CO(g)+ 2H2(g),在密闭容器中通入物质的量浓度均为0.1 molL-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强P1______P2 (填“大于”或“小于”);压强为P2时,在Y点:v(正)_____v(逆) (填“大于”、“小于”或“等于”),求Y点对应温度下的该反应的平衡常数K=________ (计算结果保留两位有效数字)。
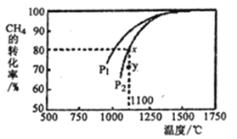
(4)以二氧化钛表面覆盖CuAlO4为催化剂,可以将CH4和CO2直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。250-300°C时,温度升高面乙酸的生成速率降低的原因是____;
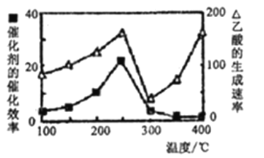
②为了提高该反应中CH4的转化率,可以采取的措施是_____________________;
(5)一定条件下,甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH溶液与b mol/ Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示,该混合溶液中醋酸的电离常数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com