
科目: 来源: 题型:
【题目】工业上冶炼钼的化学原理为:
①2MoS2+7O2![]() 2MoO3+4SO2
2MoO3+4SO2
②MoO3+2NH3·H2O=(NH4)2MoO4+H2O
③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl
④H2MoO4![]() MoO3+H2O
MoO3+H2O
⑤用还原剂将MoO3还原成金属钼。则下列说法中正确的是
A.MoS2煅烧产生的尾气可以直接排到空气中
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。

(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。指明使用镁条和氯酸钾的目的是___________________。
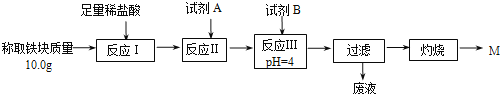
(2)某同学用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液未见红色。为测定该实验所得“铁块”中铁元素含量,设计实验流程如图所示。
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
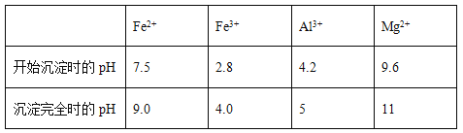
① 试剂A应选择________,试剂B应选择_______(填序号)。
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水
② 写出反应Ⅱ的离子方程式____________________________。
③ 设计简单实验证明M的成分是Fe2O3而非Fe3O4__________。
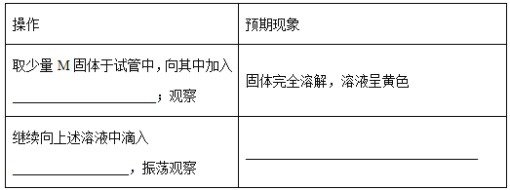
④ 上述实验应灼烧至M质量不变,则能证明M质量不变的标志是_______。
⑤ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】高锰酸钾是一种用途广泛的常见氧化剂,主要用于化工、防腐及制药工业等。
I.某课外小组设计以锰酸钾制备高锰酸钾的方案如下:
i.锰酸钾的制备:
(1)将二氧化锰、氨酸钾和氢氧化钾固体放入______(填字母)中熔融制锰酸钾。
A.烧杯B.瓷坩埚C.蒸发皿D.铁坩埚
ii.高锰酸钾的制备(装置如图所示,加热及夹持装置省略):
将i中制得的锰酸钾加少量蒸馏水溶解,得墨绿色溶液,倒入三颈烧瓶中。打开甲装置中的分液漏斗活塞加入稀硫酸,加热,使生成的乙酸进入乙装置中并水浴加热。搅拌丙装置中的溶液,锰酸钾在酸性条件下反应生成高锰酸钾和二氧化锰。
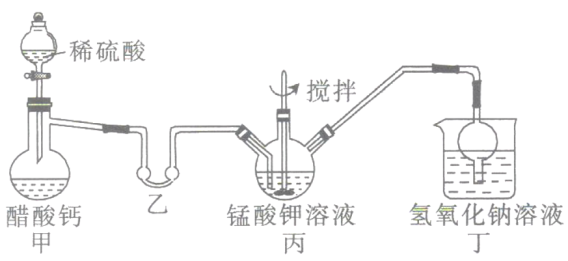
(2)检验该装置气密性的方法:连接好装置,_________________。
(3)乙装置的作用是___________;丁装置中NaOH溶液的作用是____________________。
(4)将三颈烧瓶中所得产物进行过滤,将滤液倒入蒸发皿中,_______、______、抽滤,得到针状的高锰酸钾晶体。高锰酸钾晶体只能低温烘干,其原因为_____________________。
II.利用氧化还原滴定法测定高锰酸钾的纯度,发生反应的化学方程式为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
(5)量取一定体积的高锰酸钾溶液需使用滴定管_______(填字母)。

(6)若在实验过程中存在下列操作,会使所测KMnO4浓度偏高的是____(填字母)。
A锥形瓶用水洗之后末用待测液润洗
B.盛草酸溶液的滴定管滴定前尖嘴部分有气泡,滴定终点时无气泡
C.滴定时,草酸溶液洒落瓶外
D.盛装KMnO4溶液的滴定管用水洗后,未用KMnO4溶液润洗
查看答案和解析>>
科目: 来源: 题型:
【题目】硼在冶金、核工业、农业、高新材料等方面都有重要的应用,一种利用硼镁矿制取粗研的工艺流程:
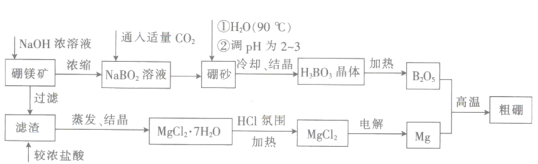
已知:硼镁矿的主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7)·10H2O。
回答下列问题:
(1)硼镁矿要粉碎处理,其目的是_______,NaOH浓溶液与硼镁矿反应的化学方程式为__________________________________(不考虑杂质参与反应)。
(2)实验室过滤操作中要用到的玻璃仪器包括烧杯、_______、______。洗涤沉淀的操作方法为_____________________________________。
(3)试解释流程中生成无水MgCl2需在HCl氛围中进行的原因:___________________。
(4)已知H3BO3为一元弱酸,其与NaOH反应的化学方程式为NaOH+H3BO3=Na[B(OH)4],写出H3BO3的电离方程式:_________________________________________。
(5)实验测得一定质量的H3BO3在不同温度下分解的曲线如图所示。图中A、B、C、D点对应得到的物质都为纯净物。
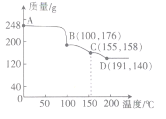
①C对应的物质可表示为2B2O3·nH2O,则n=_______
②写出C到D过程中发生反应的化学方程式:______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 除去NaHCO3固体中混有的NH4HCO3 | 直接将固体加热 |
B | 实验室收集NO2气体 | 用排水集气法收集 |
C | 检验非金属性Cl>C | 在Na2CO3溶液中加入足量HCl |
D | 检验某溶液中是否有 | 取该溶液于试管中,加入NaOH溶液后加热,用湿润的红色石蕊试纸检验 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将SO2通入2L0.01mol·L-1的某一元碱MOH溶液中,溶液中水电离出的OH-的浓度(c)与通入的SO2的体积(V)关系如图所示(不考虑+4价的S被氧化),下列叙述不正确的是
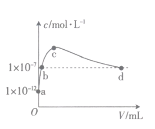
A.MOH为一元强碱
B.b点溶液中:c(H+)=1×10-7mol·L-1
C.c点溶液中:c(M+)=2[c(SO32-))+c(HSO3-)+c(H2SO3)]
D.d点溶液中:c(M+)=2c(SO32-)+c(HSO3-)
查看答案和解析>>
科目: 来源: 题型:
【题目】表示下列过程的方程式正确的是
A.氨水中一水合氨的电离方程式: NH3·H2O =![]() +OH-
+OH-
B.用浓HNO3溶解铜的离子方程式: 3Cu+2![]() + 8H+==3Cu2+ + 2NO↑+ 4H2O
+ 8H+==3Cu2+ + 2NO↑+ 4H2O
C.苯和硝酸反应的化学方程式:![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
D.钢铁发生电化学腐蚀时负极的电极反应式: Fe-3e- = Fe3+
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组利用软锰矿浆(主要成分是MnO2)吸收工业废气中的SO2,并制备硫酸锰的生产流程如下(浸出液的pH<2,其中除含Mn2+外,还含有少量Fe2+、Al3+、Ca2+等金属离子):
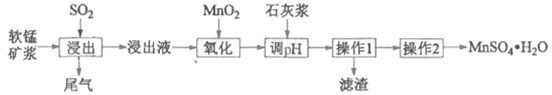
“操作1”的滤液通过阳离子吸附剂除去Ca2+。金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
(1)浸出过程中被氧化的物质的化学式为____________。
(2)氧化过程中主要反应的离子方程式为_____________
(3)在氧化后的液体中加入石灰浆调节pH, pH 的范围是__________。
(4)操作2包括蒸发浓缩、__________、 过滤、 洗涤、干燥等操作。
(5)为测定所得MnSO4·H2O的纯度,准确称取上述样品1.720 g加入适量H2SO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+后,配成200 mL溶液。取20.00 mL该溶液,向其中逐滴加入0.0500 mol·L-1的FeSO4溶液,发生如下反应: Fe2+ +Mn3+=== Fe3+ + Mn2+当反应恰好完全进行时,共消耗FeSO4溶液19.50 mL。计算MnSO4·H2O的纯度(写出计算过程,结果保留四位有效数字)__
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料, 可用作止痛剂、退热剂、防腐剂和染料中间体,乙酰苯胺的制备原理为:![]() +CH3COOH
+CH3COOH![]() +H2O,有关物质的性质如下表:
+H2O,有关物质的性质如下表:
名称 | 式量 | 性状 | 密度/g·cm-3 | 沸点/℃ | 溶解度 | |
苯胺 | 93 | 无色油状液体,易氧化 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 | 易溶于乙醇、乙醚 |
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。
实验步骤:
步骤 1:在圆底烧瓶中加入无水苯胺 9.2 mL,冰醋酸 17.4 mL,锌粉 0.1 g,安装仪器, 加入沸石,调节加热温度,使分馏柱顶温度控制在 105℃ 左右,反应约 60~80 min,反应 生成的水及少量醋酸被蒸出。
步骤 2:在搅拌下,趁热将烧瓶中的物料以细流状倒入盛 100 mL 冰水的烧杯中,剧烈搅拌,并冷却,结晶,抽滤、洗涤、干燥,得到乙酰苯胺粗品。
步 骤 3:将此粗乙酰苯胺进行重结晶,晾干,称重,计算产率。
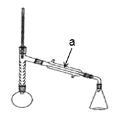
(1)仪器 a 的名称____________________;
(2)步骤 1 加热可用______________(填“水浴”或“油浴”);
(3)制备过程中加入粒的作用:___________________;
(4)从化学平衡的角度分析,控制分馏柱上端的温度在 105℃左右的原因_______________________;
(5)乙酰苯胺粗品因含杂质而显色,欲用重结晶进行提纯,步骤如下:粗产品溶于沸水中配 成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→趁热过滤→________________→过 滤→洗涤→干燥;
(6)该实验最终得到纯品 10.8g,则乙酰苯胺的产率是______________;
(7)如果重结晶过程中,加入活性炭过多,会造成产率下降,其可能原因为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】李比希是 19 世纪最著名和最有成果的化学家。他的贡献之一就是发明了燃烧法测定有机物化学组成。
Ⅰ.某物质完全燃烧后生成二氧化碳和水,现取 3.0g 该物质利用李比希法进行组成测定,无水氯化钙增重 1.8g,浓氢氧化钾溶液增重 4.4g,则该物质的最简式为_________________;
Ⅱ.多种物质符合此最简式,若要确定具体的物质,还需辅助其它的测量手段。
(1)若物质 A 的质谱图如图所示:
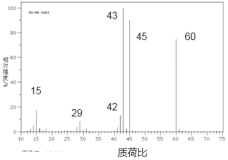
①则 A 的相对分子质量为_____________________;
②若将 A 加入到紫色石蕊试液中变红,则 A 的结构简式为________________;
(2)若测定物质 B 的蒸气密度是相同状况下 H2 的 45 倍
①则 B 的分子式为__________________;
②测定 B 的红外光谱图有 C=O 键、O—H 键、不对称—CH2—等的振动吸收峰,其核磁共振氢谱如图所示,B 的结构简式为_________________;
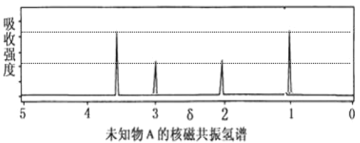
③取一定量的B物质平均分成2份,一份与足量的NaHCO3作用,一份与足量的Na作用,则产生的CO2与H2的体积比为___;
(3)若测定 C 物质的相对分子质量为 180,且 C 为淀粉水解的最终产物,并且在一定条件下, C 能与上述的 A 物质发生如下转化关系:
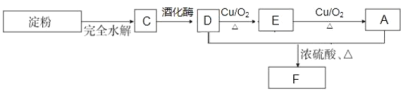
①请写出 D 变成 E 的化学方程式___________________;
②已知 G 物质为 D 物质的同系物,相对分子质量比 D 大 14,且其核磁共振H谱显示 3 组峰,面积比为 6:1:1,请写出 G 与 A 发生酯化反应的方程式____________,
Ⅲ.分别将等质量的上述A、B、C三种物质与足量的氧气反应,它们实际消耗氧气的物质的量之比为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com