
科目: 来源: 题型:
【题目】科学家艾哈迈德·泽维尔使“运用激光技术观测化学反应时原子的运动”成为可能。泽维尔研究发现,当激光脉冲照射NaI时,Na+和I—两核间距在10~15![]() (埃,1
(埃,1![]() =1×10-10m),呈现离子键;当两核靠近约2.8
=1×10-10m),呈现离子键;当两核靠近约2.8![]() 时,呈现共价键。根据泽维尔的研究成果能得出的结论是( )
时,呈现共价键。根据泽维尔的研究成果能得出的结论是( )
A. NaI晶体是离子晶体和分子晶体的混合物
B. 共价键和离子键没有明显的界限
C. NaI晶体中既有离子键,又有共价键
D. 离子晶体可能含有共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】第Ⅷ族元素![]() 、
、![]() 、
、![]() 性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
(1)基态![]() 原子核外能量最高的电子位于_______能级,同周期元素中,基态原子未成对电子数与
原子核外能量最高的电子位于_______能级,同周期元素中,基态原子未成对电子数与![]() 相同的元素名称为______________。
相同的元素名称为______________。
(2)![]() 与酚类物质的显色反应常用于其离子检验,已知
与酚类物质的显色反应常用于其离子检验,已知![]() 遇邻苯二酚(
遇邻苯二酚( )和对苯二酚(
)和对苯二酚( )均显绿色。邻苯二酚的熔沸点比对苯二酚_____(填“高”或“低”),原因是_________。
)均显绿色。邻苯二酚的熔沸点比对苯二酚_____(填“高”或“低”),原因是_________。
(3)有历史记载的第一个配合物是![]() (普鲁士蓝),该配合物的内界为__________。表为
(普鲁士蓝),该配合物的内界为__________。表为![]() 、
、![]() 不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,
不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,![]() 比较稳定的配离子配位数是__________(填“4”或“6”)。
比较稳定的配离子配位数是__________(填“4”或“6”)。![]() 性质活泼,易被还原,但
性质活泼,易被还原,但![]() 很稳定,可能的原因是________________。
很稳定,可能的原因是________________。
离子 | 配位数 | 晶体场稳定化能(Dq) |
| 6 | -8Dq+2p |
4 | -5.34Dq+2p | |
| 6 | -12Dq+3p |
4 | -3.56Dq+3p |
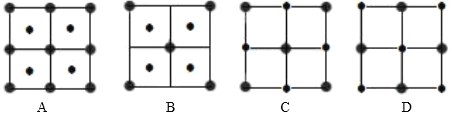
(4)![]() 晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是_______(填选项字母)。若晶胞参数为apm,阿伏加德罗常数的值为
晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是_______(填选项字母)。若晶胞参数为apm,阿伏加德罗常数的值为![]() ,晶体的密度是________
,晶体的密度是________![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)等质量的O2和O3所含分子的物质的量之比为____________。
(2)等温等压下,等体积的O2和O3所含分子个数比为________________,
(3)在反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,氧化剂是________,氧化产物是________,氧化产物与还原产物的物质的量之比为________,被氧化与未被氧化的HCl的质量之比为________,若有73 g HCl被氧化,电子转移的总数为________。
(4)配制100 mL 1 mol·L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84 g·mL-1,质量分数为98%)的体积为________mL。
查看答案和解析>>
科目: 来源: 题型:
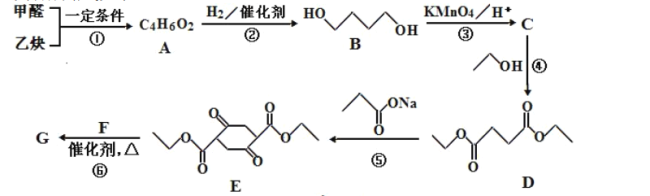
【题目】高分子化合物G(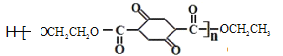 )是一种重要的合成聚酯纤维,其合成路线如下:
)是一种重要的合成聚酯纤维,其合成路线如下:
已知:
①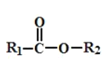 +
+ +R2OH
+R2OH
②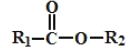 +R3OH
+R3OH![]()
 +R2OH
+R2OH
(1)F的结构简式为_______________,①的反应类型为______________,E中官能团名称为______________,⑤的反应方程式为______________。
(2)写出符合下列条件E的同分异构体______________(填结构简式,不考虑立体异构)。
①含有苯环,遇![]() 溶液不变色
溶液不变色
②能发生银镜反应
③核磁共振氢光谱图峰面积之比为1:3:6:6
(3)判断化合物E中有无手性碳原子,若有,用“*”标出_________。
(4)写出以1,3-丙二醇和甲醇为原料制备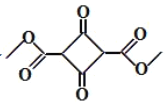 的合成路线(其它试剂任选)___________
的合成路线(其它试剂任选)___________
查看答案和解析>>
科目: 来源: 题型:
【题目】医用酒精在抗击“新型冠状病毒”战役中发挥着杀菌消毒的作用,其主要成分是乙醇。回答下列问题:
I.工业上主要采用乙烯直接水合法![]() 制乙醇。
制乙醇。
(1)在磷酸/硅藻土催化剂作用下,乙烯进行气相水合的反应机理大致如下:
i.![]()
ii.![]()
iii.![]()
随着反应进程,该过程能量变化如图所示。

下列有关说法正确的是_______(填字母标号,下同)。
a.该反应过程中i~iii步均释放能量
b.第i步反应的活化能最大,决定总反应速率
c.![]() 和
和![]() 是反应的中间产物
是反应的中间产物
(2)已知:![]() 的反应速率表达式为v正=k正
的反应速率表达式为v正=k正![]() ,v逆=k逆
,v逆=k逆![]() ,其中k正、k逆为速率常数。若其他条件不变时,降低温度,则下列推断合理的是_______。
,其中k正、k逆为速率常数。若其他条件不变时,降低温度,则下列推断合理的是_______。
a. k正增大,k逆减小 b. k正减小,k逆增大
c. k正减小的倍数大于k逆 d. k正减小的倍数小于k逆
Ⅱ.工业用二氧化碳加氢可合成乙醇:![]() 。保持压强为5MPa,向密闭容器中投入一定量
。保持压强为5MPa,向密闭容器中投入一定量![]() 和
和![]() 发生上述反应,
发生上述反应,![]() 的平衡转化率与温度、投料比
的平衡转化率与温度、投料比 的关系如图所示。
的关系如图所示。

(1)投料比由大到小的顺序为___________。
(2)若投料比![]() ,一定温度下发生反应,下列说法不能作为反应是否达平衡判据的是_______(填标号。
,一定温度下发生反应,下列说法不能作为反应是否达平衡判据的是_______(填标号。
a.容器内气体密度不再变化
b.容器内气体平均相对分子质量不再变化
c. ![]() 的体积分数不再变化
的体积分数不再变化
d.容器内 不再变化
不再变化
e.断裂![]() 个H—H键的同时生成
个H—H键的同时生成![]() 个水分子
个水分子
(3)若![]() ,则A点温度下,该反应的平衡常数
,则A点温度下,该反应的平衡常数![]() 的数值为_______(
的数值为_______(![]() 是以分压表示的平衡常数);若其他条件不变,A点对应起始反应物置于某刚性密闭容器,则平衡时
是以分压表示的平衡常数);若其他条件不变,A点对应起始反应物置于某刚性密闭容器,则平衡时![]() 的转化率___________50%(填“>”、“=”或“<”)。
的转化率___________50%(填“>”、“=”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
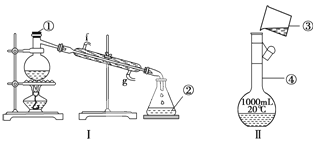
(1)写出下列仪器的名称:①__________,②__________,
(2)若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有______________,将仪器补充完整后进行的实验操作的名称为____________;
(3)用Na2CO3·10H2O晶体,配制0.2 mol·L-1的Na2CO3溶液480 mL。
①应称取Na2CO3·10H2O晶体的质量:__________。
②所用仪器除托盘天平、烧杯、玻璃棒、药匙、量筒外,还需要__________(填仪器名称)。
③根据下列操作对所配溶液的浓度产生的影响,完成下列要求:
A.Na2CO3·10H2O晶体失去了部分结晶水 |
B.用“左码右物”的称量方法称量晶体(使用游码) |
C.称量碳酸钠晶体时所用砝码生锈 |
D.容量瓶未经干燥使用 |
其中引起所配溶液浓度偏高的有___________(填字母)
④装置Ⅱ是某同学转移溶液的示意图,图中的错误是__________________
查看答案和解析>>
科目: 来源: 题型:
【题目】Zewail创立的飞秒(![]() )化学研究了极短时间内的反应历程,巧妙地解决了如何确定反应起点问题。例如
)化学研究了极短时间内的反应历程,巧妙地解决了如何确定反应起点问题。例如![]() 与
与![]() 的反应过程片段为:
的反应过程片段为:![]() 。下列有关说法正确的是( )
。下列有关说法正确的是( )
A.中间产物![]() 属于有机化合物
属于有机化合物
B.反应起点为![]() 离解为H和I自由基,终点为
离解为H和I自由基,终点为![]() 自由基与I自由基结合
自由基与I自由基结合
C.![]() 经1000fs离解为
经1000fs离解为![]() 自由基和
自由基和![]() ,说明
,说明![]() 与
与![]() 的反应速率极快
的反应速率极快
D.飞秒化学展现的反应历程为“化学反应实质是旧键断裂和新键形成”提供有力证据
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是某无机化合物的二聚分子(小球大小只代表种类不同,与原子半径大小无关),该分子中A、B两种元素都是第3周期的元素,分子中所有原子的最外层电子数都达到8个电子的稳定结构。下列说法不正确的是 ( )
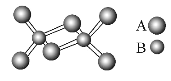
A. 该化合物的化学式是Al2Cl6
B. 该化合物是离子化合物,在熔融状态下能导电
C. 该化合物在固态时所形成的晶体是分子晶体
D. 该化合物中不存在离子键,也不含有非极性共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】室温,将10mL浓度为![]() 的
的![]() 、
、![]() 两种一元碱溶液分别加水稀释,曲线如图,V是溶液体积(mL),
两种一元碱溶液分别加水稀释,曲线如图,V是溶液体积(mL),![]() 。已知:
。已知:![]() ;
;![]() 。下列说法正确的是( )
。下列说法正确的是( )
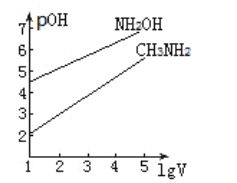
A.该温度下,![]() 的数量级为
的数量级为![]()
B.当![]() 时,水的电离程度:
时,水的电离程度:![]()
C.用等浓度盐酸分别滴定两种碱溶液至![]() ,消耗盐酸的体积:
,消耗盐酸的体积:![]()
D.等浓度的![]() 和
和![]() 两种盐溶液中离子总浓度相等
两种盐溶液中离子总浓度相等
查看答案和解析>>
科目: 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,下列有关说法正确的是( )
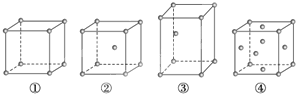
A. ①为简单立方堆积,②为镁型,③为钾型,④为铜型
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com