
科目: 来源: 题型:
【题目】由硝酸锰[Mn(NO3)2]制备的一种含锰催化剂,常温下能去除甲醛、氢氰酸(HCN)等有毒气体。
(1) Mn2+基态核外电子排布式是________________。NO3-的空间构型为__________________(用文字描述)
(2) 甲醛分子中,碳原子的杂化方式为________。
(3) HCN分子中σ键与π键的数目比为________。H、C、N三种元素的电负性由大到小的顺序为________。

(4) 硝酸锰受热可分解生成NO2和某种锰的氧化物。该氧化物晶胞结构如右图所示。写出硝酸锰受热分解的化学方程式:__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧乙酸(CH3COOOH)是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒。
(1)某学生在实验室用密度为1.15g/mL,质量分数为15%的工业品过氧乙酸配制0.1mol/L过氧乙酸溶液250mL,该生用量筒量取工业品过氧乙酸体积___________________ mL,除量筒、玻璃棒、烧杯外还需要的其它仪器是__________________________________________________________________________。
(2)该学生配制前设计了下列操作,其合理的操作顺序是___________________________________________(字母表示,每个字母只能用一次)。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需体积的工业品过氧乙酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的工业品过氧乙酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,倒置并振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响(选填“偏高” 、“ 偏低”或“无影响”)?
a. 容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水_____________________;
b. 转移溶液时,不慎有少量溶液洒在容量瓶外___________________________;
c.量取15%的工业品过氧乙酸时,仰视量筒___________________________________;
d.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,补充几滴水至刻度线____________。
(4)下列叙述正确的是__________________(填字母)。
A.可用过滤的方法将过氧乙酸溶液中混有的NaCl除掉
B.过氧乙酸包装上应贴的危险警告标签应如右图所示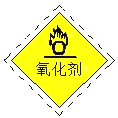
C.过氧乙酸应注意密闭、低温保存于棕色细口瓶中
D.过氧乙酸是一种有机物,它可以用于萃取碘水中的碘单质
(5)过氧乙酸半小时内会完全分解成乙酸(CH3COOH)和一种常见的气体单质,检验该气体单质的实验方法是_________________________________________________________________________________________。
(6)如果生产过氧乙酸的原料CH3COONa中混有了SO42-,要想除掉SO42-请选择下列试剂按照加入先后顺序填空_________________________(试剂不必选完,填序号)。
①盐酸②醋酸钡溶液③氯化钡溶液④醋酸⑤碳酸钠溶液⑥碳酸氢钠溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】氢能是重要的新能源,储氢技术的开发对于氢能源的推广应用是一个非常关键的技术。其中有一种方法是借助有机物储氢,其装置如图所示(忽略其它有机物,且涉及到有机物均为气体),回答下列问题:
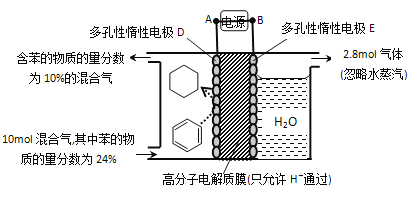
(1)该电池中A的电极名称为______
(2)写出D极生成目标产物的电极反应式______
(3)D极收集到新生成的气体有______;通过此方法储氢后,共收集到混合气体的物质的量为______
(4)该储氢装置的电流效率为______(计算结果保留三位有限数字。已知:电流效率=生成目标产物消耗的电子数/转移的电子总数×100%)
查看答案和解析>>
科目: 来源: 题型:
【题目】把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。下列对该反应的说法不正确的是

A. IO4﹣作氧化剂
B. 若有1 mol Mn2+参加反应转移5mol电子
C. 还原剂与氧化剂的物质的量之比为2:5
D. 配平后H+、Mn2+的化学计量数分别为4、2
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2 ,则下列说法中正确的是( )
2KClO3 + H2C2O4 + H2SO4 ![]() 2ClO2↑ + K2SO4 + 2CO2↑ + 2H2O
2ClO2↑ + K2SO4 + 2CO2↑ + 2H2O
A. KClO3在反应中是还原剂
B. 1molKClO3参加反应,在标准状况下能得到22.4L气体
C. 在反应中H2C2O4 既不是氧化剂也不是还原剂
D. 1molKClO3参加反应有1mol电子转移
查看答案和解析>>
科目: 来源: 题型:
【题目】夹紧下列装置中的弹簧夹并进行相关操作。下列情形中,表明相应装置漏气的是( )
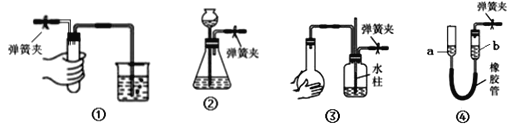
A. 装置①中,用手捂住试管,烧杯中出现气泡,放开手后,导管中形成一段稳定的水柱
B. 装置②中,向长颈漏斗中加入一定量水,形成水柱,随后水柱下降至与瓶中液面相平的位置
C. 装置③中,双手捂住烧瓶,导管中形成一段稳定的水柱,双手放开后,水柱慢慢回落
D. 装置④中,将a管向上提至一段高度,a、b两管之间水面形成稳定的高度差
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G对白色念珠菌具有较强的抑制作用。G可经下图所示合成路线制备:
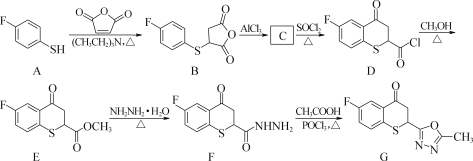
请回答下列问题:
(1) A→B的反应类型是________。
(2) E中含氧官能团的名称为________和________。
(3) C与B互为同分异构体,能与小苏打反应放出CO2,且能与SOCl2发生取代反应生成D。写出C的结构简式:________。
(4) 写出同时满足下列条件的D的一种同分异构体的结构简式:________。(不考虑立体异构)
①含有—SH结构;
②能在酸性条件下发生水解反应,两种水解产物均含有三种不同环境的H原子。其中一种水解产物既能遇FeCl3溶液显色,又能与Br2的CCl4溶液发生加成反应。
(5) 写出以甲苯和乙醇为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用氧化锌作催化剂、以乙二醇和碳酸氢钠为复合解聚剂常压下快速、彻底解聚聚对苯二甲酸乙二醇酯,同时回收对苯二甲酸和乙二醇。反应原理如下:
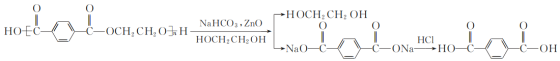
实验步骤如下:
步骤1:在题图1所示装置的四颈烧瓶内依次加入洗净的矿泉水瓶碎片、氧化锌、碳酸氢钠和乙二醇,缓慢搅拌,油浴加热至180 ℃,反应0.5 h。
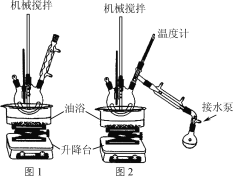
步骤2:降下油浴,冷却至160 ℃,将搅拌回流装置改为图2所示的搅拌蒸馏装置,水泵减压,油浴加热蒸馏。
步骤3:蒸馏完毕,向四颈烧瓶内加入沸水,搅拌。维持温度在60 ℃左右,抽滤。
步骤4:将滤液转移至烧杯中加热煮沸后,趁热边搅拌边加入盐酸酸化至pH为1~2。用砂芯漏斗抽滤,洗涤滤饼数次直至洗涤滤液pH=6,将滤饼摊开置于微波炉中微波干燥。
请回答下列问题:
(1) 步骤1中将矿泉水瓶剪成碎片的目的是______________________________。
(2) 步骤2中减压蒸馏的目的是____________________,蒸馏出的物质是________。
(3) 抽滤结束后停止抽滤正确的操作方法是________。若滤液有色,可采取的措施是________。
(4) 该实验中,不采用水浴加热的原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某十钒酸铵[(NH4)xH6-xV10O28·yH2O(其中钒为+5价)]常用来制造高端钒铝合金。
Ⅰ. (NH4)xH6-xV10O28·yH2O的制备
将NH4VO3溶于pH为4的弱酸性介质后,加入乙醇,过滤得到(NH4)xH6-xV10O28·yH2O晶体。乙醇的作用是____________________________________。
Ⅱ. (NH4)xH6-xV10O28·yH2O的组成测定
(1) NH4+含量测定
准确称取0.363 6 g该十钒酸铵晶体,加入蒸馏水和NaOH溶液,加热煮沸,生成的氨气用20.00 mL 0.100 0 mol·L-1盐酸标准溶液吸收。用等浓度的NaOH标准溶液滴定过量盐酸,消耗NaOH标准溶液8.00 mL。
(2) V10O![]() (M=958 g·mol-1)含量测定
(M=958 g·mol-1)含量测定
步骤1:准确称取0.3636 g该十钒酸铵晶体,加入适量稀硫酸,微热使之溶解。
步骤2:加入蒸馏水和NaHSO3,充分搅拌,使V10O![]() 完全转化为VO2+。
完全转化为VO2+。
步骤3:加适量稀硫酸酸化,加热煮沸,除去溶液中+4价硫。
步骤4:用0.020 00 mol·L-1 KMnO4标准溶液滴定,终点时消耗30.00 mL KMnO4标准溶液(该过程中钒被氧化至+5价,锰被还原至+2价)。
①写出步骤2反应的离子方程式:____________________________________。
②若未进行步骤3操作,则数值y将________(填“偏大”“偏小”或“无影响”)。
③通过计算确定该十钒酸铵晶体的化学式(写出计算过程)。________
查看答案和解析>>
科目: 来源: 题型:
【题目】EPR橡胶(![]() )和PC塑料的合成路线如下:
)和PC塑料的合成路线如下:

已知:
①![]() +
+![]() +
+![]()
②化合物F能与FeCl3溶液发生显色反应,分子中含有两个化学环境完全相同的甲基,其苯环上的一硝基取代物只有两种。
(1)下列说法正确的是______
A C不能使酸性高锰酸钾溶液褪色
B 反应Ⅱ、Ⅲ的原子利用率为100%
C 1molE与足量的金属钠反应,最多可生成22.4L的H2
D 塑料PC的合成中CH3OH可以循环使用
(2)反应Ⅳ的反应类型为______,F的结构简式为______
(3)反应Ⅳ的化学方程式是______
(4)写出同时满足下列条件的![]() 的所有同分异构体的结构简式(不考虑立体异构)______
的所有同分异构体的结构简式(不考虑立体异构)______
a 属于酯类 b 能发生银镜反应
(5)已知:![]() 以D与乙酸为其实原料合成
以D与乙酸为其实原料合成![]() ,无机试剂任选,写出合成路线(注:合成路线示意图:CH3CHO
,无机试剂任选,写出合成路线(注:合成路线示意图:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOHCH2CH3)______
CH3COOHCH2CH3)______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com