
科目: 来源: 题型:
【题目】(1)K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O氧化剂是______,氧化产物与还原产物的物质的量之比为_______。
(2)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2, 完成下列化学方程式(横线上填系数,括号内填物质):① ___KMnO4+____K2S+______===___K2MnO4+___K2SO4+___S↓+______。
② 若生成6.4g单质硫,反应过程中转移电子的物质的量为___。
(3)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染,化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为____ L。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是( )
A. 1 mol Cl2与过量Fe粉反应生成FeCl3,转移2NA个电子
B. 4.7 g核素![]() 发生裂变反应:
发生裂变反应:![]() +
+![]()
![]()
![]() +
+![]() +3
+3![]() ,净产生的中子(
,净产生的中子(![]() )数为0.06NA
)数为0.06NA
C. 1 mol Zn与一定量浓硫酸恰好完全反应,则生成的气体分子数为NA
D. 在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成1 mol Cl2转移的电子数为1.75NA
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列物质能导电的是___,属于电解质的是___。
①NaCl晶体 ②液态SO2 ③液态醋酸 ④铜 ⑤BaSO4固体 ⑥纯蔗糖(C12H22O11) ⑦氨水 ⑧熔化的KNO3
(2)0.5molCH4的质量是___g,在标准状况下的体积为___L;
(3)8.4g氮气和9.6g某单质Rx所含原子个数相同,且分子个数之比为3:2,则x的值是___,R的摩尔质量是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数,则下列说法正确的是( )
A. 0.1 mol/L K2SO4溶液含有K+ 0.2NA
B. 标准状况下,11.2L水所含的电子数为5NA
C. 常温常压下,16g O2含电子数为10NA
D. 0.1 mol Mg原子变成Mg2+时失去的电子数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿 (主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如图:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)Al的原子结构示意图为_________;Al与NaOH溶液反应的离子方程式为________。
(2)“碱溶”时生成偏铝酸钠的离子方程式为_______________。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_________,阴极产生的物质A的化学式为____________。
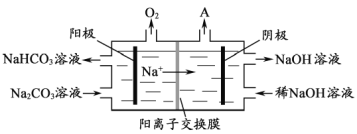
查看答案和解析>>
科目: 来源: 题型:
【题目】冬季的降雪给交通带来了诸多不便,其中醋酸钾(CH3COOK)是融雪效果最好的融雪剂,下列关于醋酸钾的说法正确的是( )
A.1 molCH3COOK的质量为98g/mol
B.含有6.02×1023个碳原子的CH3COOK的物质的量是1mol
C.一个CH3COO-的质量约为![]() g
g
D.CH3COOK摩尔质量就是它的相对分子质量
查看答案和解析>>
科目: 来源: 题型:
【题目】图甲表示叶绿体的结构,图乙表示暗反应过程。请据图回答下列问题:

(l)叶绿体中的色素分布于图甲中的____ (填序号);四种色素能在滤纸条上分离,是因为____。
(2)叶绿体进行光合作用时,ATP的移动方向是从____到____(填序号),合成ATP所需的能量来自____。
(3)在光照强度、温度和CO2浓度三种环境因素中,能直接影响图乙所示过程的是 _________。若突然降低光照强度,则在短时间内叶绿体中C3和C5的含量变化分别是 _________、________。
查看答案和解析>>
科目: 来源: 题型:
【题目】1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36gcm-3.实验室制备少量1-溴丙烷的主要步骤如下:
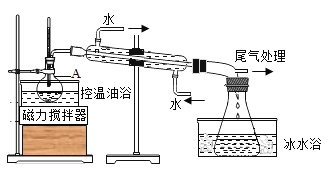
步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20mL水,冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24gNaBr。
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用12mLH2O、12mL5%Na2CO3溶液和12mLH2O洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。
(1)步骤1发生反应的方程式为______
(2)仪器A的名称是______;加入搅拌磁子的目的是搅拌和______。
(3)反应时生成的主要有机副产物有______。
(4)反应过程中可以观察到A的上方出现红棕色气体,其电子式为______。
(5)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是______。同时可以观察到的现象是______。
(6)步骤4中三次洗涤分别洗去的主要杂质是①______②______③______。
(5)步骤4中②的Na2CO3溶液还可以用下列哪个试剂代替______
A. NaOH溶液 B. NaI溶液 C. Na2SO3溶液 D. CCl4
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸。
(1)操作①的名称是_________。
(2)试剂a是_________,试剂b 是_________ 。
(3)加入试剂a所发生反应的离子方程式为_________。加入试剂b所发生反应的离子方程式为_________。
(4)该方案能否达到实验目的:_____(填“能”或“不能”)。若不能,应如何改进? _____(若能,此问不用回答)。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外。至少还要获得的数据是_________的质量。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程如下图所示:
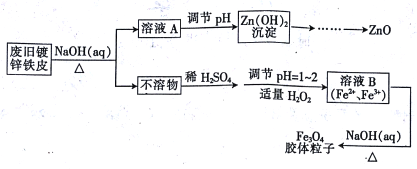
(1)从流程图可知,Zn、Fe中能与NaOH溶液反应的是________。
(2)Zn(OH)2沉淀加热可得ZnO,该反应______(填“是”或“不是”)氧化还原反应。
(3)向不溶物中加入稀H2SO4发生反应的离子方程式是_________。
(4)加入适量H2O2的目的是_________。
(5)如何证明已生成了Fe3O4胶体? _________。
(6)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L 硫酸,该硫酸的物质的量浓度为__mol/L
(7)稀硫酸也可以用浓硫酸和水配制。已知4mol/L的硫酸溶液密度为ρ1 g/cm3,2mol/L的硫酸溶液密度为ρ2 g/cm3。100g物质的量浓度为4mol/L 的硫酸溶液与___mL水混合,使硫酸的物质的量浓度减小到2mol/L。(用含ρ1、ρ2的式子表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com