
科目: 来源: 题型:
【题目】氯化亚铁是重要的还原剂。常用于检测硒,生产氯化铁、聚合氯化铝铁絮凝剂。制备FeCl2的方法有多种。已知:

请回答下列问题:
(1)在一定浓度的盐酸中,逐渐加入过量的铁屑,充分反应后,蒸发至出现晶膜,___、___固液分离,洗涤,快速干燥制得。
(2)如图,用H2还原无水FeCl3制取FeCl2。
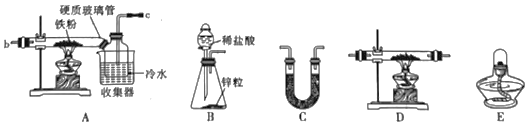
①图A是用干燥的Cl2和铁粉制取无水FeCl3的装置。硬质玻璃管和收集器用大口管连接的原因是____。
②装置B、C、D、E是用H2还原无水FeCl3制取FeCl2的装置。连接顺序为(可重复使用)___,仪器C中盛放的试剂是___。
(3)按如图所示装置,用162.5g无水氯化铁和225g氯苯,控制反应温度加热3h。冷却,分离提纯得到粗产品。反应为:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl。
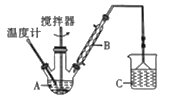
①仪器B的作用是___;C中倒挂漏斗的作用是___。
②反应的温度最好控制在132℃左右。则最佳的加热方式为___(填序号)。
A.直接用酒精灯加热 B.隔石棉网用酒精灯加热
C.水浴加热 D.油浴加热
③通过烧杯C现象变化可以监控氯化铁的转化率。若烧杯C中试剂为加有酚酞且含18gNaOH的溶液,则氯化铁转化率理论上达到或超过___%。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)标准生成热指的是在某温度下,由处于标准状态的各种元素的最稳定的单质生成标准状态下 1mol 某纯物质的热效应,单位常用 kJ/mol表示,已知在 25℃的条件下:
①Ag2O(s)+2HCl(g)═2AgCl(s)+H2O(l)△H=-324.4 kJ/mol
②2Ag(s)+ ![]() O2(g)═Ag2O(s)△H=-30.56kJ/mol
O2(g)═Ag2O(s)△H=-30.56kJ/mol
③ ![]() H2(g)+
H2(g)+ ![]() Cl2(g)═HCl(g)△H=-92.21 kJ/mol
Cl2(g)═HCl(g)△H=-92.21 kJ/mol
④H2(g)+ ![]() O2(g)═H2O(l)△H=-285.6 kJ/mol
O2(g)═H2O(l)△H=-285.6 kJ/mol
则25℃时氯化银的标准生成热为________ kJ/mol;
(2)实验测得 64g 甲醇[CH3OH(l)]在氧气中充分燃烧生成 CO2 气体和液态水时放出 1452.8kJ 的热量,则表示甲醇燃烧热的热化学方程式_________________;
(3)以甲烷、氧气为原料,KOH 为电解质,构成燃料电池,写出其负极的电极反应式:________;
(4)电解法制取有广泛用途的 Na2FeO4,工作原理如下图所示。
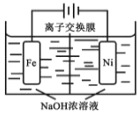
已知:Na2FeO4 只在强碱性条件下稳定。
①Na2FeO4能够净水的主要原因是_______________ 。
②阳极电极反应式 _______________;
③为使电解能较持久进行,应选用_______________ 离子交换膜(填“阴”或“阳”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究硫酸亚铁的分解产物,将硫酸亚铁样品装入下图的硬质玻璃管中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红棕色粉末。
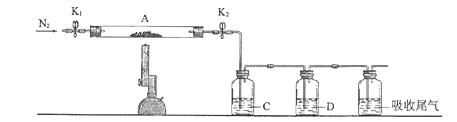
(1)C中的溶液为_______(填标号)。D中观察到的现象为___________。
a .品红 b .NaOH c. BaCl2 d. Ba(NO3)2 e. 浓H2SO4
(2)写出硫酸亚铁高温分解反应的化学方程式_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)①石墨 ②烧碱 ③石灰水 ④氯化钠晶体 ⑤盐酸 ⑥氨气 ⑦蔗糖 ⑧氯气 ⑨液态氯化氢 ⑩硫酸溶液上述物质中能导电的是______,属于电解质的是_______,属于非电解质的是________。(填编号)
(2)按要求写出下列方程式:
①小苏打治疗胃酸过多的离子方程式:____________________。
②向氢氧化钠溶液中加入的铝片离子方程式:__________________。
(3)按要求进行化学计算:
①0.5mol某固体A的质量是40 g,A的相对分子质量为__________________。
②在同温同压同体积的条件下,H2与气体A的质量之比是1∶8,则A的摩尔质量为_____________。
③2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O,该反应氧化剂与还原剂的物质的量之比为________。
④98%的浓H2SO4(ρ=1.84 g/cm3)物质的量浓度为__________。
⑤相同物质的量浓度的NaCl、MgCl2、AlCl3溶液,分别与足量的AgNO3溶液反应,当生成的AgCl质量相同时,消耗的三种溶液的体积比为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】合成某药物的中间体G的流程如图:
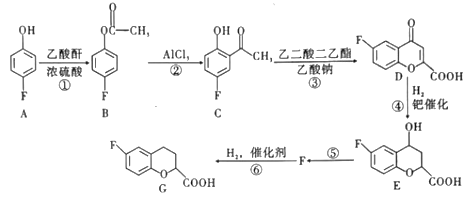
请回答下列问题:
(1)A的名称为___(系统命名法),F的分子式为___。反应⑤的反应类型是___。
(2)C中含氧官能团的名称为__。
(3)已知一定条件下2分子乙酸分子间脱水生成1分子乙酸酐,写出该反应的化学方程式:___。
(4)写出满足下列条件的E的同分异构体的结构简式:___。
①苯环上只有三个取代基;
②核磁共振氢谱图中只有4组吸收峰;
③1mol该物质与足量NaHCO3溶液反应生成2molCO2。
(5)根据已有知识并结合相关信息,写出以C6H5—OOCCH2CH3为原料制备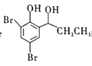 的合成路线流程图(无机试剂任选)。___。
的合成路线流程图(无机试剂任选)。___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如图所示(部分反应物或生成物未列出),其中E为白色沉淀,I为红褐色沉淀。
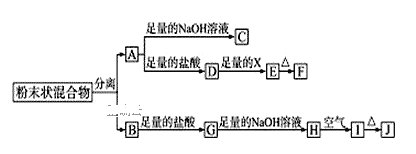
(1)写出下列物质的化学式:F___,G___。
(2)分离粉末状混合物最简单的方法是___。
(3)D→E转化中,加入足量的X,试剂X可能是___,写出其离子方程式___。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)A→C的离子方程式___。
(5)检验G溶液中的阳离子的方法___。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知 A 与 H2、CO 以物质的量 1∶1∶1 的比例形成 B,B能发生银镜反应,C 分子中只有一种氢,相关物质转化关系如下(含有相同官能团的有机物通常具有相似的化学性质):

请回答:
(1)有机物 C 的结构简式是________,反应②的反应类型是________。
(2)写出一定条件下发生反应①的化学方程式___________。
(3)下列说法不正确的是________(填字母)。
A.化合物 A 属于烃
B.化合物 D 含有两种官能团
C.用金属钠无法鉴别化合物 F、G
D.A 与 D 一定条件下可以生成 CH3CH2OCH2CH2OH
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧化镍在乙醇的悬浊液中可发生反应生成单质镍的配合物:Ni(OH)2+5CH3NC=(CH3NC)4Ni+CH3NCO+H2O。
(1)基态镍原子的未成对电子数为__,钯(Pd)与镍位于同一族,且Pd是Ni的下一周期元素,基态钯原子的未成对电子数为0,基态钯原子的外围电子排布式为___。
(2)CH3NCO中四种元素的第一电离能由大到小的顺序为___。CH3NC(结构简式为CH3—N≡C)分子中甲基碳原子的杂化轨道类型是___。
(3)用光气(COCl2)与甲胺(CH3NH2)可以制取CH3NCO。与COCl2互为等电子体的一种阴离子为___。
(4)如图,在镍的催化作用下,甲基呋哺与氨在高温下反应得到甲基吡咯。甲基吡咯的熔、沸点高于甲基呋喃的原因是_____________。

(5)(CH3NC)4Ni可作为储氢材料,某种镁铝合金也可作为储氢材料,该合金晶胞结构如图所示,晶胞棱长为anm,该合金的化学式为___,该晶体的密度为__g·cm-3(阿伏加德罗常数的数值用NA表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】中国是世界上最大的钨储藏国,超细钨粉是生产硬质合金所必须的原料。
(1)工业上可以采用铝热还原法生产钨铁合金,已知:
①WO3(s)+2Al(s)=W(s)+Al2O3(s) H1
②3Fe3O4(s)+8Al(s)=9Fe(s)+4Al2O3(s) H2
则四氧化三铁与钨反应的热化学方程式为___(反应热写为H3并用含△H1、AH2的代数式表示);在反应②中若有0.1molFe3O4参加反应,则转移电子___mol。
(2)自然界中钨主要存在于黑钨矿中(主要成分是铁和锰的钨酸盐),从中制备出黄钨(WO3)后再用H2逐级还原:WO3→WO2.90→WO2.72→WO2→W,总反应为3H2(g)+WO3(s)![]() W(s)+3H2O(g) H,实验测得一定条件下平衡时H2的体积分数曲线如图所示:
W(s)+3H2O(g) H,实验测得一定条件下平衡时H2的体积分数曲线如图所示:
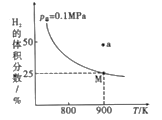
①由图可知,该反应的H____(填“>”或“<”)0;a点处的v正___v逆(填“>”“<”或“=”)。
②如果上述反应在体积不变的密闭容器中达到平衡,下列说法错误的是__(填序号)。
A.v正(H2)=v逆(H2O)
B.加入WO3,则H2的转化率增大
C.容器内气体的密度不变时,一定达到平衡状态
D.容器内压强不变时,一定达到平衡状态
③由图可知900K,氢气的平衡转化率为__,Kp(900K)=____(用平衡分压代替平衡浓度计算,已知:平衡分压=p总×气体物质的量分数)。
④已知在高温下,氧化钨会与水蒸气反应生成一种挥发性极强的水钨化合物WO2(OH)2,因此在反应中要适当加快氢气的流速,原因是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25°C时有关弱酸的电离平衡常数如下表:
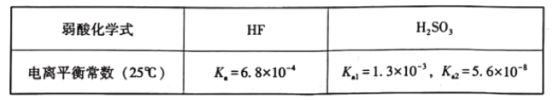
下列有关说法正确的是( )
A.等物质的量浓度的各溶液pH关系:pH(Na2SO3)<pH(NaF)<pH(NaHSO3)
B.将0.lmo/L的HF与0.1mol/L的NaF等体积混合,混合液pH>7
C.Na2SO3溶液中加入足量HF发生反应的离子方程式为SO32-+HF=F-+HSO3-
D.NaHSO3溶液中部分微粒浓度的大小:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com