
科目: 来源: 题型:
【题目】氢气因热值高、来源广、产物无污染,常被人们看做一种理想的“绿色能源”,氢气的制取是氢能源利用领域的研究热点。
(1)H2O的热分解可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图1中曲线A对应的物质是______________。

(2)图2为用电解法制备H2,写出阳极的电极反应式:________________。
(3)从可持续发展考虑,太阳能光解水制氢是获取H2的最好途径,但迄今仍然存在诸多问题,如光催化剂大多仅在紫外光区稳定有效,能够在可见光区使用的光催化剂不但催化活性低,而且几乎都存在光腐蚀现象,需使用牺牲剂进行抑制,能量转化效率低等,这些都阻碍了光解水的实际应用,需设计课题进一步研究解决。下列设想符合研究方向的是_________
A 将研究方向专注于紫外光区,无需考虑可见光区
B 研究光腐蚀机理,寻找高稳定性,不产生光腐蚀的制氢材料
C 研制具有特殊结构的新型光催化剂,开发低成本、高性能光催化材料
D 研究新的光解水的催化机制,使利用红外光进行光解水制氢成为可能
(4)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:CH4(g) + H2O(g) = CO(g)+ 3H2 (g) ΔH= -206.2 kJmol-1
CH4(g) + CO2 (g) = 2CO(g)+ 2H2 (g) ΔH= -247.4 kJmol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:_________
(5)利用废弃的H2S的热分解可生产H2:2H2S(g) ![]() 2H2(g)+S2(g)。现将0.30 mol H2S(g)通入到压强为p的恒压密闭容器中,在不同温度下测得H2S的平衡转化率如图3所示:
2H2(g)+S2(g)。现将0.30 mol H2S(g)通入到压强为p的恒压密闭容器中,在不同温度下测得H2S的平衡转化率如图3所示:
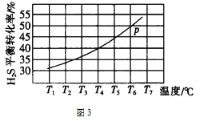
①温度为T4℃时,初始体积为1L,t分钟后,反应达到平衡,该温度下的平衡常数K=________。
②若保持恒温T℃,将一定量的 H2S(g)通入到恒压密闭容器中,反应一段时间后,压强为p的体系恰好达到平衡,试在图4上画出不同起始压强下H2S转化率的趋势图________。

查看答案和解析>>
科目: 来源: 题型:
【题目】某澄清溶液中可能含有Na+、K+、NH4+、Mg2+、Fe2+、SO42﹣、SO32﹣、Cl﹣、I﹣、CO32﹣中的若干种,且离子浓度都相等。现取该溶液进行有关实验,实验结果如下图所示:
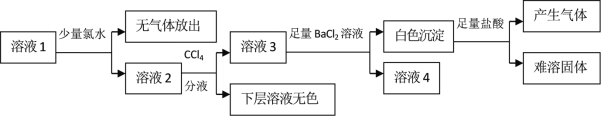
下列关于该溶液的说法中正确的是
A.通过CCl4层无色可以推知原溶液中一定不存在I-
B.向白色沉淀中加入盐酸产生气体并留有难溶固体可推知原溶液中存在SO32﹣和CO32-
C.该溶液中不可能同时存在NH4+和Cl-
D.另取该溶液加入足量浓NaOH溶液,加热,若试管口的湿润红色石蕊试纸不变蓝,则可确定原溶液中所有离子的存在情况
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学反应与能量变化的说法正确的是
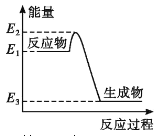
A. 如图所示的化学反应中,反应物的键能之和大于生成物的键能之和
B. 相同条件下,氢气和氧气反应生成液态水比生成等量的气态水放出的热量少
C. 金刚石在一定条件下转化成石墨能量变化如图所示,热反应方程式可为:C(s金刚石) =C(s,石墨) H=-(E2—E3)kJ·mol—1
D. 同温同压下,H2(g)+C12(g)==2HCl(g)能量变化如图所示,在光照和点燃条件下的△H相同
查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示的是纯净物、单质、化合物、含氧化合物、氧化物、碱之间的包含、不包含关系,若整个大圆圈代表纯净物,则下列选项中,能正确指出①、②、③、④、⑤所属物质类别的是( )
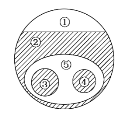
A. ①单质、③化合物
B. ②碱、⑤氧化物
C. ④碱、⑤含氧化合物
D. ④含氧化合物、③氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】G是某抗炎症药物的中间体,其合成路线如下:

已知:①![]()
![]()

② ![]()
![]()
![]() (呈碱性,易氧化)
(呈碱性,易氧化)
(1)C的官能团名称是_______________;
(2)反应①的反应类型为___________;反应②的作用是___________________;
(3)下列对有机物G的性质推测不正确的是____________________ (填选项字母);
A.1molG与足量NaHCO3溶液反应放出2molCO2
B.能发生取代反应和氧化反应
C.能加聚合成高分子化合物
D.具有两性,既能与酸反应也能与碱反应
(4)写出E→F的化学反应方程式______________________________;
(5)同时符合下列条件的D的同分异构体有__________种:
①含有苯环且能发生水解反应:②能发生银镜反应;③能与NaHCO3溶液反应放出CO2。
(6)已知:苯环上有烷烃基时,新引入的取代基连在苯环的邻、对位:苯环上有发基时,新引入的取代基连在苯环的问位。根据题中的信息,写出以甲苯为原料合成有机物的流程图 (无机试剂任选)_______________________________________________________________________________________。 合成路线流程图示例:X
(无机试剂任选)_______________________________________________________________________________________。 合成路线流程图示例:X![]() Y
Y![]() Z……目标产物
Z……目标产物
查看答案和解析>>
科目: 来源: 题型:
【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2
实验流程如下:
C6H12O6溶液![]()
![]()
![]() 滤液
滤液![]() 悬浊液
悬浊液![]()
![]()
![]() Ca(C6H11O7)2
Ca(C6H11O7)2
已知:葡萄糖酸钙微溶于乙醇,可溶于冷水,易溶于热水。则下列说法不正确的是
A.第②步充分反应后CaCO3固体需有剩余,其目的是确保葡萄糖酸完全转化为钙盐
B.第④步加入乙醇的作用是减小葡萄糖酸钙在水中的溶解量,使其结晶析出
C.第⑤步过滤时,发现有固体产品残留在原容器壁上,可加少量热水冲洗再转移至过滤器内
D.可用O2代替Br2,在葡萄糖氧化酶作用下氧化葡萄糖进而制备葡萄糖酸钙
查看答案和解析>>
科目: 来源: 题型:
【题目】硼(B)钴(Co)和锰(Mn)形成物质时比较复杂和变化多端。
(1) Co基态原子核外电子排布式为_________,第二周期元素第一电离能比B高的有______种;
(2)硝酸锰是工业制备中常用的催化剂,Mn(NO3)2中的化学键除了σ键外,还存在______;
(3)NaBO2可用于织物漂白。BO2-的空间构型为_______写出两种与其互为等电子体的分子的化学式:_______;
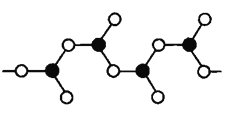
(4)下图表示偏硼酸根的一种无限长的链式结构,其化学式可表示为____(以n表示硼原子的个数);
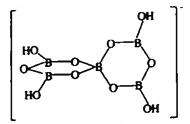
下图表示的是一种五硼酸根离子, 其中B原子的杂化方式为________;
(5)立方BN和立方AIN均为原子晶体,结构相似,BN的熔点高于AIN的原因为_______________;
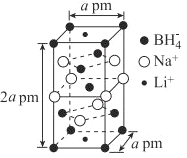
(6)一种新型轻质储氢材料的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,该晶体的密度为__gcm-3(用含a、NA的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,起始浓度为0.1mol.L-1的亚硫酸溶液中,H2SO3、HSO3-、SO32-三种微粒的物质的量分数(即微粒本身物质的量与三种粒子总物质的量之比)随pH变化的关系如图所示。下列说法正确的是

A.读取图中数据计算可得到常温下亚硫酸溶液的Ka2≈10-7
B.向该体系中加入一定量的NaOH固体,HSO3-的物质的量分数一定增大
C.在pH=1.0溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-)
D.在该体系中的任意一点都存在:c2(H+)=c(H+)·c(HSO3-)+2c(H+)c(SO32-)+Kw
查看答案和解析>>
科目: 来源: 题型:
【题目】在汽车上安装高效催化转化器,可发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H,减少汽车尾气污染。某研究性学习小组在两个初始条件完全相同的恒温恒容密闭容器中充入一定量的NO和CO气体,甲组不加催化剂,乙组加入催化剂,分别用气体传感器测得不同时间的NO和CO浓度如表:
N2(g)+2CO2(g) △H,减少汽车尾气污染。某研究性学习小组在两个初始条件完全相同的恒温恒容密闭容器中充入一定量的NO和CO气体,甲组不加催化剂,乙组加入催化剂,分别用气体传感器测得不同时间的NO和CO浓度如表:
时间(s) | 甲 | 乙 | |||||||||||
0 | 1 | 2 | 3 | 4 | 5 | 0 | 1 | 2 | 3 | 4 | 5 | ||
c(NO)(×10-4mol/L) | 10.0 | 10.0 | 10.0 | 10.0 | 10.0 | 10.0 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 | |
c(CO)(×10-3mol/L) | 3.60 | 3.60 | 3.60 | 3.60 | 3.60 | 3.60 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 | |
下列说法正确的是:
A.通过甲乙组数据对比可知,催化剂可以让原来不能自发进行的反应体系自发进行
B.根据化学反应原理综合分析可知:反应2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) 的△H<0
N2(g)+2CO2(g) 的△H<0
C.乙容器中,0~
D.达到平衡后,将容器乙中各物质的浓度均加倍,则体系K值增加,平衡正向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】燃煤烟气中含有大量NOx和SO2,可经处理消除。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+ 4NO2(g) 4NO(g)+CO2(g)+ 2H2O(g); H1=574.0 kJ ·mol-1
CH4(g)+4NO(g) 2N2(g)+ CO2(g)+ 2H2O(g); H2= 1160.0 kJ·mol-1
①反应CH4(g)+2NO2(g) N2(g)+CO2(g)+ 2H2O(g); H3=_____;
②若该反应中将NOx还原为N2,消耗标准状况下5.6L CH4,则反应过程中转移的电子物质的量为___;
(2)用CH4原NO2的反应为CH4(g)+ 2NO2(g) N2(g)+CO2(g)+ 2H2O(g),向两个容积均为2L温度分别为T1°C、T2°C的恒温恒容密闭容器中分别加入物质的量为1 mol的CH4和2molNO2,测得各容器中n(NO2)随反应时间t的变化如图所示:

①T1_______T2(填“>”或“<”);
②T1°C时,40~80 min,用N2的浓度变化表示的平均反应速率为v(N2)=_____,此温度下的化学平衡常数K=______;
③T1°C下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡_____移动(填“正向”、 “逆向”或“不”);
(3)亚氯酸钠(NaClO2)和次氯酸钠(NaClO)碱性混合液作为复合吸收剂可脱除烟气中的NOx、SO2,使其转化为NO3-、SO42-。
①写出NO与NaClO2反应的离子方程式:__________________________;
②下图表示在一定条件下温度与复合吸收剂对烟气中SO2、NO脱除效率的关系。图中SO2比NO脱除效率高的原因可能是____________________________ ( 答出一点即可);

(4)用碱液脱硝是目前研究的课题之一。
①将NO、NO2 控制物质的量之比接近1:1通入足量氢氧化钠溶液可制NaNO2溶液。请写出该反应的离子方程式______________________________。
②将工业上氢氧化钠溶液脱硝得到的NaNO2、NaNO3的混合液和NaOH溶液分别加到下图所示的电解槽中进行电解。写出A室NO2发生的电极反应:____________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com