
科目: 来源: 题型:
【题目】数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为___________________,第一电离能最小的元素是__________(填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是___________(填化学式)。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为__________;另一种的晶胞如图二所示,该晶胞的空间利用率为__________。(![]() =1.732)
=1.732)
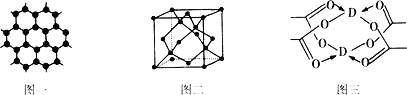
(4)D元素形成的单质,其晶体的堆积模型为__________,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是__________ (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是______________________________。
请写出上述过程的离子方程式:___________________________,__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨催化氧化是硝酸工业的基础,氦气在Pt催化剂作用下发生主反应Ⅰ和副反应Ⅱ:
Ⅰ.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H1=-905 kJ/mol
4NO(g)+6H2O(g) △H1=-905 kJ/mol
Ⅱ.4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H2
2N2(g)+6H2O(g) △H2
(1)已知:
物质中断裂1mol化学键需要的能量/kJ | NO | O2 | N2 |
629 | 496 | 942 |
则△H2=___________。
(2)以Pt为催化剂,在1L密闭容器中充入1mol NH3和2mol O2,测得有关物质的量与温度的关系如下图:

①该催化剂在高温时对反应__________更有利(填“Ⅰ”或“Ⅱ”)。
②520℃时,NH3的转化率为____________。
③520℃时,反应Ⅱ的平衡常数K=________(数字计算式)。
④下列说法正确的是____________(填标号)。
A 工业上氨催化氧化生成NO时,最佳温度应控制在840℃左右
B 增大NH3和O2的初始投料比可以提高NH3生成NO的平衡转化率
C 投料比不变,增加反应物的浓度可以提高NH3生成NO的平衡转化率
D 使用催化剂时,可降低反应的活化能,加快其反应速率
⑤温度高于840℃时,NO的物质的量减少的原因可能是____________。
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1mol N2时,转移的电子数为___________mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂的反应器中反应。
反应相同时间NOx的去除率随反应温度的变化曲线如下图所示,在50-250℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是_______________。

查看答案和解析>>
科目: 来源: 题型:
【题目】实验测得0.5 mol·L1CH3COONa溶液、0.5 mol·L1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是
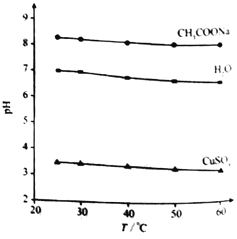
A. 随温度升高,纯水中c(H+)>c(OH)
B. 随温度升高,CH3COONa溶液的c(OH)减小
C. 随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO、Cu2+水解平衡移动方向不同
查看答案和解析>>
科目: 来源: 题型:
【题目】有关晶体的叙述中正确的是( )
A.在SiO2晶体中,由Si、O构成的最小单元环中共有8个原子
B.在28g晶体硅中,含Si﹣Si共价键个数为4NA
C.金刚石的熔沸点高于晶体硅,是因为C﹣C键键能小于Si﹣Si键
D.镁型和铜型金属晶体的配位数均为12
查看答案和解析>>
科目: 来源: 题型:
【题目】新型镁-锂双离子二次电池如图,下列关于该电池的说法不正确的是

A. 放电时,Li+由左向右移动
B. 放电时,正极的电极反应式为Li1-xFePO4+xLi++xe-= LiFePO4
C. 充电时,外加电源的正极与Y相连
D. 充电时,导线上每通过1mol e-,左室溶液质量减轻12g
查看答案和解析>>
科目: 来源: 题型:
【题目】用VSEPR模型预测下列分子或离子的立体结构,其中正确的是()
A.H2O与BeCl2为V形B.CS2与SO2为直线形
C.BF3与PCl3为三角锥形D.SO3与CO32-为平面三角形
查看答案和解析>>
科目: 来源: 题型:
【题目】咖啡酸(如图),存在于许多中药,如野胡萝卜、光叶水苏、荞麦等中。咖啡酸有止血作用。下列关于咖啡酸的说法不正确的是
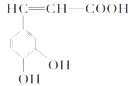
A.咖啡酸的分子式为C9H8O4
B.1 mol咖啡酸可以和含4 molBr2的浓溴水反应
C.1 mol咖啡酸与足量NaHCO3溶液反应能产生标况下约67.2L的CO2
D.不可以用高锰酸钾检验咖啡酸分子中的碳碳双键
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要0.5mol/L CuSO4溶液450mL和0.5mol/L硫酸溶液500mL,根据这两种溶液的配制情况回答下列问题:
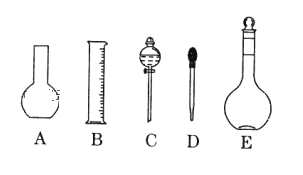
(1)如图所示的仪器中配制溶液肯定不需要的是 _____(填序号),配制上述 CuSO4溶液需用到的玻璃仪器除了烧杯、玻璃棒、量筒还有_______(填仪器名称)。
(2)下列操作中,容量瓶所不具备的功能有_________(填序号)。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体 D.用来加热溶解固体溶质
(3)配制CuSO4溶液时,如果用CuSO4固体,应该称量固体的质量为________;如果用CuSO4· 5H2O固体配制,应该称量固体的质量为__________。配制硫酸溶液时,需要取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为__________。
(4)下列操作对溶液的浓度有何影响?(填“偏大”、“偏小”、“无影响”)
①没有对溶解固体时用到的烧杯洗涤_______________。
②使用前容量瓶用蒸馏水洗涤,且没有干燥_______________。
③配制的过程中有少量的液体迸溅出来_______________。
④定容时不小心加水过量,马上用胶头滴管吸出_______________。
⑤定容时俯视刻度线_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NiCl2是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产NiCl2,继而生产Ni2O3的工艺流程如下:

流程中相关金属离子生成氢氧化物沉淀的pH如下表所示:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.1 | 6.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③_______________等。
(2)加入H2O2的目的是____________,所发生的离子方程式为____________________。
(3)“除铁”时,控制溶液pH的范围为_____________________。
(4)滤渣B的主要成分的化学式为___________________,滤液中的阳离子有________。
(5)“氧化”生成Ni2O3的离子方程式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
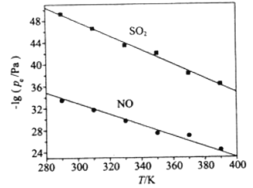
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”或“减小”)。
②反应ClO2+2SO32 2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com