
科目: 来源: 题型:
【题目】关于下列各装置图的叙述中,正确的是( )
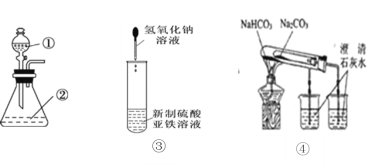
A.用如图装置进行实验,将装置①中的AlCl3滴入装置②浓氢氧化钠溶液中可观察到有大量白色沉淀产生
B.利用装置③可制备氢氧化亚铁并长时间观察其颜色
C.装置④不能验证Na2CO3和NaHCO3两种固体的热稳定性
D.用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来说明金属铝的熔点较低
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20mL0.1molL﹣1的H2A(二元弱酸)溶液中滴加0.1mol/L的NaOH溶液,溶液pH随NaOH溶液体积的变化如图所示。下列说法正确的是

A.a点的溶液中:c(Na+)>c(A2)>c(HA)>c(H+)>c(OH)
B.b点的溶液中:c(H2A)+c(H+)=c(A2)+c(OH)
C.c点溶液的pH>7,是因为此时HA的电离能力小于其水解能力
D.若将0.1molL﹣1的NaOH溶液换成同浓度的氨水,当滴加40mL时,此时溶液的pH>9.85
查看答案和解析>>
科目: 来源: 题型:
【题目】铜及其化合物在生产生活中有广泛应用
(1)工业上以黄铜矿(CuFeS2)为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S![]() 6Cu+SO2↑该反应的氧化剂是________________,验证SO2的方法是________________。
6Cu+SO2↑该反应的氧化剂是________________,验证SO2的方法是________________。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜。温度控制在50℃~60℃的原因有:①加快反应速率;②___________。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,可生成CuC1沉淀,写出生成CuCl的离子方程式______________。
(3)碱式碳酸铜在有机催化剂、烟火制造和颜料、农药生产中有广泛的应用。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备碱式碳酸铜的流程如下:
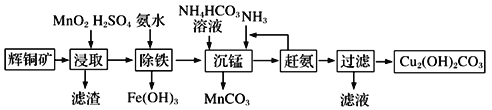
①辉铜矿在浸取前要富集与粉碎,粉碎的好处是___________。
②浸取过程中可得到一种黄色单质,写出浸取时主要反应的化学方程式___________。
③“除铁”这一步反应在25℃进行,加入氨水调节溶液pH为4后,溶液中铜离子最大浓度不超过_________mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应:2A(g)B(g)。分别取1molA于2L的固定体积的容器中,分别在T1和T2下,测得A的转化率随时间变化的关系曲线如图所示。下列说法正确的是
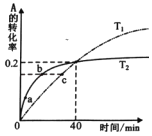
A.升高温度可缩短反应到达平衡的时间同时能提高A平衡的转化率
B.从反应开始至40min时,T2温度下生成B的物质的量比T1温度下多
C.图中a、b、c三点的化学反应速率依次减小
D.用B表示T1温度下前40min的平均反应速率:v(B)=0.0025molL﹣1min﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示.下列选项中正确的是
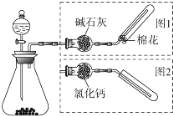
选项 | 发生装置中的药品 | 干燥和集气装置 |
A | 电石和饱和食盐水 | 图2 |
B | 大理石和稀盐酸 | 图1 |
C | 铜和稀硝酸 | 图2 |
D | 氧化钙和浓氨水 | 图1 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式或化学方程式正确的是( )
A.铁与水蒸气在高温下反应:2Fe+3H2O![]() Fe2O3+3H2
Fe2O3+3H2
B.Na投入水中:Na+H2O=Na++OH-+H2↑
C.氢氧化铁胶体的制备Fe3++3H2O=Fe(OH)3↓+3H+
D.大理石溶于醋酸的反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是一种新型锂电池装置,电池充、放电反应为![]()
![]()
![]() 。放电时,需先引发铁和氯酸钾反 应使共晶盐熔化。下列说法不正确的是
。放电时,需先引发铁和氯酸钾反 应使共晶盐熔化。下列说法不正确的是
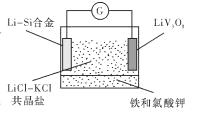
A. 共晶盐储热效果好,利于电解质熔化
B. 整个过程的能量转化只涉及化学能转化为电能
C. 放电时LiV3O8电极的反应为xLi++xe-+LiV3O8= Li1+XV3O8
D. 充电时 Cl-移向LiV3O8电极
查看答案和解析>>
科目: 来源: 题型:
【题目】有部分被氧化了的Fe-Cu合金样品(氧化产物Fe2O3、CuO)5.76g,经如下处理:

下列说法正确的是( )
A.滤液A中的阳离子Fe2+ 、Fe3+、H+B.样品Fe元素的质量为2.24g
C.样品CuO的质量4.0gD.V=336
查看答案和解析>>
科目: 来源: 题型:
【题目】向含有amol AlCl3溶液中加入含有bmol KOH溶液,生成沉淀的物质的量可能是
①amol ②bmol ③a/3mol ④b/3mol ⑤0 mol ⑥(4a-b)mol
A.①③④⑤⑥B.①②③④⑤C.①④⑤⑥D.①④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于48。X的一种1∶1型氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单元为正方体(如图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。
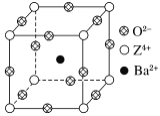
(1) Y在周期表中位于______________;Z4+的核外电子排布式为___________________。
(2)X的该种氢化物分子构型为________,X在该氢化物中以_______方式杂化。X和Y形成的化合物的熔点应该_______(填“高于”或“低于”)X氢化物的熔点。
(3)①制备M的化学方程式是_____________。
②在M晶体中,若将Z4+置于正方体的体心,Ba2+置于正方体的顶点,则O2-处于正方体的________。
③在M晶体中,Z4+的氧配位数为________。
④已知O2-半径为1.40×10-10 m,则Z4+半径为____ m。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com