
科目: 来源: 题型:
【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取少量黑色固体,洗涤后,_______(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3 min时量少;溶液红色较3 min时加深 |
ⅲ | 120 | 产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据_______现象,判断溶液中存在Ag+,可产生Fe3+。
③ 下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是________________。
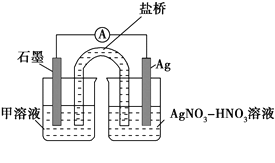
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】改变0.1mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数φ(X)随pH的变化如图所示。
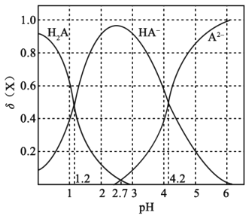
下列叙述错误的是( )
A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下,将224LHCl气体溶解于635mL水中,所得盐酸的密度为:1.18gcm﹣3。试计算:
(1)所得盐酸的质量分数和物质的量浓度是多少?___、___
(2)取出这种盐酸100mL,稀释至1.18L,求所得稀盐酸的物质的量浓度。___
(3)将含有少量Na2CO3的NaOH样品2.53g,加入50.0mL2.00molL﹣1的盐酸中,充分反应后,生成标准状况下二氧化碳气体112mL,溶液酸性,中和多余的酸又用去40.0mL1.00molL﹣1的NaOH溶液.蒸发中和后的溶液,最终得到多少克固体?___
查看答案和解析>>
科目: 来源: 题型:
【题目】PH3是一种无色剧毒气体,其分子结构和NH3相似,但P—H键键能比N—H键键能低。下列判断错误的是
A. PH3沸点低于NH3沸点,因为P—H键键能低
B. PH3分子是极性分子
C. 一个PH3分子中,P原子核外有一个孤电子对
D. PH3分子稳定性低于NH3分子,因为N—H键键能高
查看答案和解析>>
科目: 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.已知铜在常温下能被稀HNO3溶解。反应方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO ↑+4H2O
(1)请将上述反应改成离子方程式____。
(2)用双线桥法表示电子得失的方向和数目:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O。___
(3若生成896mL的NO(标准状况下),则该过程中转移的电子数目是___。
(4)氧化剂与氧化产物的物质的量比为___。
Ⅱ.某反应体系有反应物和生成物共7种物质:C、H2SO4、K2CrO4、K2SO4、CO2、Cr2(SO4)3和H2O。已知该反应中发生如下过程:C→CO2。该反应的化学方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】反-2-己烯醛(D)是一种重要的合成香料,下列合成路线是制备D的方法之一。根据该合成路线回答下列问题:
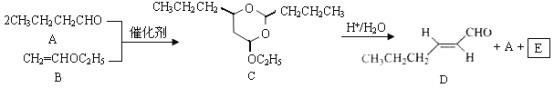
已知: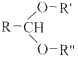
![]() RCHO+R'OH+R"OH
RCHO+R'OH+R"OH
(1)A的名称是__________;B分子中共面原子数目最多为__________;C分子中与环相连的三个基团中,不同化学环境的氢原子共有__________种。
(2)D中含氧官能团的名称是__________,写出检验该官能团的化学反应方程式:__________。
(3)E为有机物,能发生的反应有__________。
a.聚合反应b.加成反应c.消去反应d.取代反应
(4)B的同分异构体F与B有完全相同的官能团,写出F所有可能的结构:________。
(5)以D为主要原料制备己醛(目标化合物),在方框中将合成路线的后半部分补充完整。
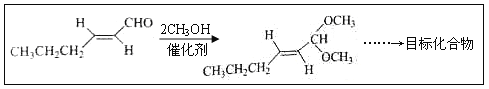
(6)问题(5)的合成路线中第一步反应的目的是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
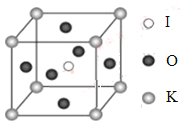
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。
查看答案和解析>>
科目: 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
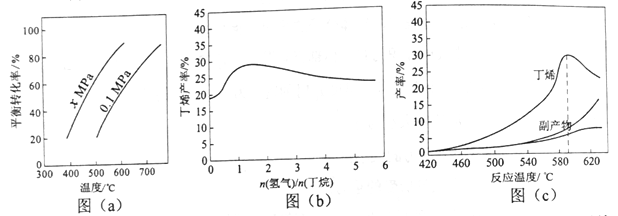
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2 的的资源化利用是解决温室效应的重要途径。以下是在一定条件下用 NH3捕获 CO2生成重要化工产品三聚氰酸的反应:NH3+CO2→ +H2O。下列有关三聚氰酸的说法正确的是( )
+H2O。下列有关三聚氰酸的说法正确的是( )
A.C、N、O 原子采用相同的杂化方式B.分子中既含极性键,又含非极性键
C.分子式为C3H3N3O3D.生成该物质的上述反应为中和反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com