已知A、B、C、D、E、F、G是原子序数依次增大的短周期元素,其中A原子的核内无中子;B原子的最外层电子数是内层电子数的2倍且B、C、D同周期并相邻;D与G同主族;E、F、G同周期且它们的最高价氧化物的水化物两两之间都可以相互反应生成盐和水.请回答下列问题:
(1)D的简单阴离子的结构示意图是
;F元素在周期表中的位置是
第3周期第ⅢA
第3周期第ⅢA
.
(2)D、E、F的单核离子半径由大到小的顺序为
O 2->Na+>Al 3+
O 2->Na+>Al 3+
(用离子符号表示);证明B、G非金属性强弱的实验方法和现象是
向Na2CO3溶液中加入稀硫酸产生大量无色无味气体
向Na2CO3溶液中加入稀硫酸产生大量无色无味气体
.
(3)D与A按1:1原子个数比组成的化合物的电子式为
;D与E按1:1原子个数比组成的化合物与二氧化碳反应的化学方程式为
2Na2O2+2CO2=Na2CO3+O2
2Na2O2+2CO2=Na2CO3+O2
.
(4)由D、F、G组成的一种常见易溶性盐可用作净水剂,其原因是
Al 3++3H2O?Al(OH)3(胶体)+3H+,生成的胶体与水中的杂质作用形成沉淀
Al 3++3H2O?Al(OH)3(胶体)+3H+,生成的胶体与水中的杂质作用形成沉淀
(用离子方程式及必要的文字说明).
(5)工业上常用A、C元素组成的一种常见气态化合物经过三步反应来制取硝酸,则第一步反应的化学方程式为
;将G元素的一种常见气态氧化物通入C元素最高价氧化物对应的水化物中,反应的离子方程式为
3SO2+2NO3-+2H2O=3SO42-+2NO+4H+
3SO2+2NO3-+2H2O=3SO42-+2NO+4H+
.





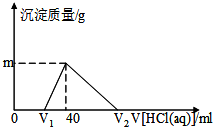 将一定质量的钠铝合金置于水中,合金全部溶解得到20ml混合溶液,其中NaOH的物质的量浓度为0.5mol/L.向该溶液中滴加0.5mol/L稀盐酸,测得生成沉淀的质量与消耗稀盐酸的体积关系如图所示,则下列有关说法中不正确的是( )
将一定质量的钠铝合金置于水中,合金全部溶解得到20ml混合溶液,其中NaOH的物质的量浓度为0.5mol/L.向该溶液中滴加0.5mol/L稀盐酸,测得生成沉淀的质量与消耗稀盐酸的体积关系如图所示,则下列有关说法中不正确的是( )