
科目: 来源: 题型:
【题目】氢能被誉为21世纪的“终极能源”,具有高效、高压、环保、体积小等特点,氢能转化被视为新能源汽车终极解决方案,也是资本与技术趋之若鹜的领域。镧镍合金LaNix是一种良好的储氢材料。工业上可用下列方法冶炼镍。
![]()
(1)一个电子的运动状态取决于________种因素,基态Ni原子核外电子占据_____个不同原子轨道。
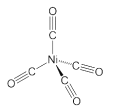
(2)CO分子内σ键和π键个数之比为________;已知Ni(CO)4的结构如图所示,中心原子Ni的杂化类型为_________,Ni原子参与形成了______个配位键,Ni(CO)4属于______晶体,理由是________________________________。
(3)研究发现镧镍合金LaNix属六方晶系,其晶胞如图a中实线或图a所示,储氢位置有两种,分别是八面体空隙(“![]() ”)和四面体空隙(“
”)和四面体空隙(“![]() ”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。

①LaNix合金中x的值为_______;
②晶胞中和“![]() ”同类的八面体空隙有____个,和“▲”同类的四面体空隙有____个。
”同类的八面体空隙有____个,和“▲”同类的四面体空隙有____个。
③若H进入晶胞后,晶胞的体积不变,H的最大密度是______________g/cm-3(保留2位有效数字,NA=6.0×1023![]() =1.7)。
=1.7)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个固定容积的密闭容器中,可逆反应m A(g)+n B(g)![]() p C(g)+q D(g),当 m、 n、 p、q 为任意整数时,下列说法一定能说明反应已达到平衡的是( )
p C(g)+q D(g),当 m、 n、 p、q 为任意整数时,下列说法一定能说明反应已达到平衡的是( )
①体系的压强不再改变 ②体系的密度不再改变 ③各组分的浓度不再改变 ④各组分的质量分数不再改变 ⑤反应速率 v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q ⑥单位时间内 m mol A 发生断键反应,同时 p mol C 也发生断键反应
A. ③④⑤⑥ B. ③④⑥ C. ①③④ D. ②③⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】向容积为2 L的密闭容器中充人2 mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g) ![]() 3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
①用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
A. ①②③ B. ①③ C. ②④ D. ①④
查看答案和解析>>
科目: 来源: 题型:
【题目】将a克块状碳酸钙与足量盐酸反应,固体反应物消耗的质量m随时间t的变化曲线如下图实线所示。在相同条件下,将b克(a>b)粉末状碳酸钙与足量的溶质质量分数相等的盐酸反应,则相应的曲线(图中虚线所示)正确的是 ( )
A. B.
B. C.
C. D.
D.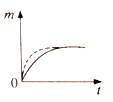
查看答案和解析>>
科目: 来源: 题型:
【题目】氮硫的氧化物是造成大气污染的主要物质。研究它们的反应机理,对于消除环境污染有重要意义。
(1)2NO(g)+O2(g)=2NO2(g)△H的反应机理和各基元反应(基元反应是指在反应中一步直接转化为产物的反应,又称为简单反应)的活化能为:
2NO(g)![]() N2O2(g)E1=82kJ·mol-1v=k1c2(NO)
N2O2(g)E1=82kJ·mol-1v=k1c2(NO)
N2O2(g)![]() 2NO(g)E-1=205kJ·mol-1v=k-1c(N2O2)
2NO(g)E-1=205kJ·mol-1v=k-1c(N2O2)
N2O2(g)+O2(g)![]() 2NO2(g)E2=82kJ·mol-1v=k2c(N2O2)·c(O2)
2NO2(g)E2=82kJ·mol-1v=k2c(N2O2)·c(O2)
2NO2(g)![]() N2O2(g)+O2(g)E-2=72kJ·mol-1v=k-2c2(NO2)
N2O2(g)+O2(g)E-2=72kJ·mol-1v=k-2c2(NO2)
①2NO(g)+O2(g)![]() 2NO2(g)△H=______kJmol-1,平衡常数K与上述反应速率常数k1、k-1、k2、k-2的关系式为K=_______;
2NO2(g)△H=______kJmol-1,平衡常数K与上述反应速率常数k1、k-1、k2、k-2的关系式为K=_______;
②某温度下反应2NO(g)+O2(g)![]() 2NO2(g)的速率常数k=8.8×10-2L2mol-2s-1,当反应物浓度都是0.05molL-1时,反应的速率是__________________molL-1s-1;若此时缩小容器的体积,使气体压强增大为原来的2倍,则反应速率增大为之前的______倍。
2NO2(g)的速率常数k=8.8×10-2L2mol-2s-1,当反应物浓度都是0.05molL-1时,反应的速率是__________________molL-1s-1;若此时缩小容器的体积,使气体压强增大为原来的2倍,则反应速率增大为之前的______倍。
(2)2SO2(g)+O2(g)![]() 2SO3(g)反应过程中能量变化如图1所示。在V2O5存在时,该反应的机理为:V2O5+SO2
2SO3(g)反应过程中能量变化如图1所示。在V2O5存在时,该反应的机理为:V2O5+SO2![]() 2VO2+SO3(快)4VO2+O2
2VO2+SO3(快)4VO2+O2![]() 2V2O5(慢)
2V2O5(慢)
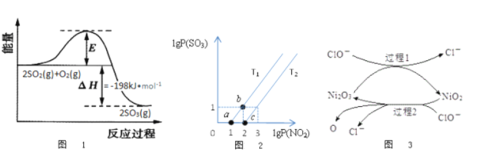
下列说法正确的是___________
A.反应速率主要取决于V2O5的质量
B.VO2是该反应的催化剂
C.逆反应的活化能大于198kJ/mol
D.增大SO2的浓度可显著提高反应速率
(3)某研究小组研究T1℃、T2℃时,氮硫的氧化物的转化:NO2(g)+SO2(g)![]() NO(g)+SO3(g)中lgP(NO2)和lgP(SO3)关系如图2所示,实验初始时体系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。
NO(g)+SO3(g)中lgP(NO2)和lgP(SO3)关系如图2所示,实验初始时体系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。
①根据题意可知:T1______T2(填“>”“<”或者“=”),理由是___________________。
②由平衡状态a到b,改变的条件是__________________。
(4)工业上可用NaClO碱性溶液或“亚硫酸盐法”吸收SO2。为了提高吸收效率,常用Ni2O3作为催化剂。催化过程如图3所示。
①过程2的离子方程式_______________________________。
②Ca(C1O)2也可用于脱硫,且脱硫效果比NaC1O更好,原因是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年9月起,澳大利亚山火已经持续100多天,产生了大量温室气体。有50mLNaOH溶液,向其中逐渐通入一定量的CO2,然后向溶液中逐滴加入0.1mol/L的稀盐酸,产生的CO2气体体积(标准状况)与所加入的盐酸的体积之间的关系如图所示。下列说法正确的是

A.滴加盐酸过程中,混合溶液的导电能力不断增强
B.滴加盐酸过程中,混合溶液中c(CO32-)、c(HCO3-)、c(H2CO3)之和不断减小
C.V(稀盐酸)=25mL时,c(H+)+c(H2CO3)=c(CO32-)+c(OH-)
D.V(稀盐酸)=50mL时,c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。用太阳能电池给磷酸铁锂锂离子电池充电示意图如图所示,阳极反应式为:LiFePO4-xe-=xLi++Li1-xFePO4。下列叙述错误的是
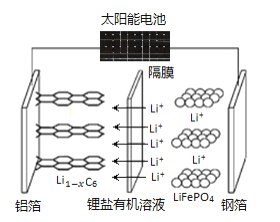
A.晶体硅能将太阳能转化为电能,但硅太阳能电池不属于原电池
B.该锂电池放电时负极反应为:LixC6-xe-=xLi++Li1-xC6
C.该锂电池放电时,电子通过外电路由铝箔流向钢箔
D.磷酸铁锂锂离子电池充放电过程通过Li+迁移实现,Fe、C、P元素化合价均不发生变化
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,科学家、合成了一系列具有独特化学性质的氢铝化合物(AlH3)n,常用作还原剂。已知,最简单的氢铝化合物的化学式为Al2H6,它的熔点为150℃且熔融状态不能导电,燃烧时放出大量的热量。Al2H6的球棍模型如下图所示。下列说法正确的是

A.Al2H6中Al为-3价,H为+1价
B.Al2H6中含有离子键和极性共价键
C.Al2H6为离子化合物
D.Al2H6在空气中完全燃烧,产物为氧化铝和水
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。W、X、Y、Z均为短周期元素,原子序数依次增加,其中W、X、Z组成的化合物M、N、R之间存在如图所示的反应。下列叙述正确的是

A.元素非金属性的顺序为X>Y>Z>W
B.M、N、R三种分子中,所有原子均满足8电子稳定结构
C.M、N、R三种分子均含有极性键和非极性键
D.W、X、Y、Z四种元素既可形成离子化合物,又可形成共价化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W均为短周期主族元素,它们在周期表中的相对位置如图所示,下列说法中正确的是( )
![]()
A.Y的价层电子排布式是![]()
B.四种元素所形成的最简单氢化物中,沸点最高的是可能Y的氢化物
C.Y、Z之间可形成离子型化合物
D.X、Z、W的最高价氧化物所对应的水化物不可能均是强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com