
科目: 来源: 题型:
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1)
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1)
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,达到平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.若温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应①X(g)+2Y(g) ![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g) ![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:

下列判断正确的是( )
A.反应①的正反应是吸热反应
B.达到平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为14:15
C.达到平衡(Ⅰ)时,X的转化率为5/11
D.在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数相等
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是某品牌饮用矿泉水标签的部分内容。下列说法正确的是

A. 标签上离子的浓度是物质的量浓度
B. 由矿泉水制蒸馏水必需使用的玻璃仪器有:圆底烧瓶、酒精灯、温度计、冷凝管、牛角管和锥形瓶
C. 该品牌饮用矿泉水中c(Mg2+)最大值为2×10-4mol/L
D. 一瓶该品牌饮用矿泉水中SO42-的物质的量不超过l×10-5mol
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4LCCl4中含原子总数为5NA
B.物质的量浓度为0.5![]() MgCl2溶液中,含有Cl—数目为NA
MgCl2溶液中,含有Cl—数目为NA
C.常温常压下,NA个CO2分子占的体积大于22.4L
D.3.2g由氧气和臭氧组成的混合物中含有氧气分子的数目为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目: 来源: 题型:
【题目】青蒿素是一种用于治疗疟疾的药物,挽救了全球特别是发展中国家数百万人的生命,它的分子式为C15H22O5。NA表示阿伏伽德罗常数,下列关于青蒿素的说法不正确的是( )
A.青蒿素的摩尔质量等于282![]() B.14.1g青蒿素中含氧原子数目为0.05NA
B.14.1g青蒿素中含氧原子数目为0.05NA
C.1mol青蒿素完全燃烧,生成11NA个H2OD.10g青蒿素中![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是十分重要的自然资源.如图是海水资源利用的部分过程,下列有关说法错误的是
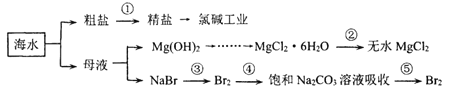
A.第①步除去粗盐中的 Ca2+、Mg2+、SO42-等杂质离子加入试剂顺序为:NaOH 溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
B.第②步由MgCl26H2O在空气中受热分解来制取无水MgCl2
C.第③步可通入Cl2,第④⑤步的目的是富集溴元素
D.海水淡化的方法主要有蒸馏法、电渗析法和离交换法
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关苯 (![]() ) 与(3)-轴烯 (
) 与(3)-轴烯 (![]() )的说法错误的是
)的说法错误的是
A.二者互为同分异构体
B.二者可用酸性KMnO4溶液鉴别
C.(3)-轴烯与足量H2反应所得产物的二氯代物有5种
D.苯分子中所有原子共平面,(3)-轴烯分子中所有原子不可能共平面
查看答案和解析>>
科目: 来源: 题型:
【题目】ZrO2常用陶瓷材料,可由锆英砂(主要成分为ZrSiO4, 也可表示为ZrO2SiO2还含少量FeCO3、Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:

已知:①ZrSiO4能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+;
②常温下,Ksp[Fe(OH)3= 1×10-38,Ksp [(Al(OH)3= 1×10-32;pH=6.2时,ZrO2+开始沉淀.
(1)“熔融”过程中 ,ZrSiO4发生反应的化学方程式为______________________;滤渣 I的化学式为________________________。
(2)“除杂”过程中,加入双氧水的目的是________________:此过程中为使滤液I中的杂质离子沉淀完全而除去(当离子浓度c≤1×10-5 molL-1时即为沉淀完全) ,室温下加氪水调节pH范围为____________________。
(3)为得到纯净的ZrO2滤渣III要用水洗,检验沉淀是否洗涤干净的方法是_______。
(4)滤渣III的成分是Zr(CO3)2 nZr(OH)4。“调 pH=8.0”时,所发生反应的离子方程式为_______________________;滤渣III制备ZrO2的方法是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com