
科目: 来源: 题型:
【题目】自然界存在丰富的碳、氮、氧、铝、钾、铁、碘等元素,按要求回答下列问题:
(1)常温,羰基铁[Fe(CO)x)]是红棕色液体,不溶于水,溶于乙醇、乙醚等,据此判断羰基铁晶体属于________________(填晶体类型),羰基铁的配体是________。已知:羰基铁的中心原子价电子数与配体提供电子数之和为18,则x=_________;98g羰基铁中含有的![]() 键数为______________个。
键数为______________个。
(2)亚铁离子具有强还原性,从电子排布的角度解释,其原因是__________
(3)BN晶体、AlN晶体结构相似,如图1,两者熔沸点较高的物质是______,原因是_________
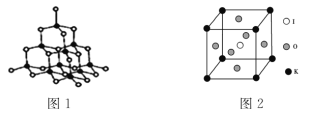
(4)KIO3晶体是一种性能良好的光学材料,其晶胞为立方体,晶胞中K、I、O分别处于顶点、体心、面心位置,如图2所示,如果KIO3密度为a g![]() cm-3,则K与O间的最短距离为___cm。
cm-3,则K与O间的最短距离为___cm。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物M(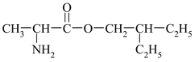 )是合成药物瑞德西韦的中间体,其合成途径如图:
)是合成药物瑞德西韦的中间体,其合成途径如图:

已知:![]() +HCN→
+HCN→ (R和R′均表示烃基或氢原子)
(R和R′均表示烃基或氢原子)
完成下列填空:
(1)M中含氧官能团的名称为___。反应①~③中属于取代反应的有___。反应⑤的化学方程式为___。
(2)反应④需要在无水条件下进行,如何检验反应③所得产物中的水已被除净?___。
(3)写出两种满足下列条件的有机物的结构简式___。
①(C2H5)2CHOH的同分异构体,②能发生消除反应且只生成一种烯烃。
(4)聚甲基丙烯酸( )常用作胶黏剂、锅炉阻垢剂以及合成离子交换树脂。根据已有知识并结合题目流程中的信息,设计由丙酮(
)常用作胶黏剂、锅炉阻垢剂以及合成离子交换树脂。根据已有知识并结合题目流程中的信息,设计由丙酮(![]() )制备甲基丙烯酸(
)制备甲基丙烯酸(![]() )的合成路线___。
)的合成路线___。
(合成路线常用的表示方式为:A![]() B
B![]() 目标产物)
目标产物)
查看答案和解析>>
科目: 来源: 题型:
【题目】己知A、B、C、D、E五种元素的核电荷数依次增大,A原子中p轨道电子数是s轨道电子数的一半;C、D同主族,且D的原子序数是C的2倍;E是第四周期ds区不活泼金属元素。根据以上信息用相应的元素符号填空:
(1)E+核外电子排布式为_______________,DC42-离子的空间构型为_____________________。
(2)ABC三元素第一电离能大小顺序为________________。
(3)D元素在周期表中的位置_______________,能导电的A单质与B、D、E的单质形成的晶体相比较,熔点由高到低的排列顺序是__________________(填化学式)。
(4)已知EDC4溶液中滴入氨基乙酸钠![]() 即可得到配合物G。其结构如图所示:
即可得到配合物G。其结构如图所示:

配合物G中碳原子的轨道杂化类型为_________________________________。
(5)(AB)2的电子式为____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是( )
A.a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为71b/a
B.5.6 g CO和22.4 L CO2中含有的碳原子数一定相等
C.将20 g NaOH固体溶解在500 mL水中所得溶液的物质的量浓度为1 mol·L-1
D.现有等物质的量的CO和CO2,这两种气体中氧原子的质量之比为1∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是(假设金属的摩尔质量为Mg·mol-1金属原子半径为r cm,用NA表示阿伏加德罗常数的值)
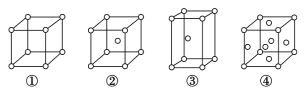
A.金属Zn采用②堆积方式
B.①和③中原子的配位数分别为:6、8
C.对于采用②堆积方式的金属的晶胞质量为![]()
D.金属锻压时,会破坏密堆积的排列方式
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+6H2O。某学习小组对铁丝(含杂质碳)与浓硫酸反应后的产物进行探究。
Fe2(SO4)3+3SO2↑+6H2O。某学习小组对铁丝(含杂质碳)与浓硫酸反应后的产物进行探究。
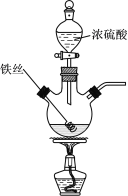
Ⅰ.溶液探究
(1)将反应后的溶液稀释,取稀释液,滴加NaOH溶液,观察到___现象时,证明有Fe3+存在。为进一步判断溶液中是否存在Fe2+,可另取稀释液少许,滴加___(选填编号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.KMnO4酸性溶液
(2)为判断反应停止后硫酸是否有剩余,制定的实验方案为:测定稀释液的pH。请对此实验设计进行评价。____。
Ⅱ.气体探究
(3)将产生的气体依次通过品红溶液和澄清石灰水,观察到:品红溶液褪色、澄清石灰水变浑浊。是否___(填写“是”或“否”)能据此判断除SO2外,反应后气体中还含有CO2?请说明理由___。
最后逸出的气体具有可燃性,推测该气体为H2,理由是___(用离子方程式表示)。
(4)收集混合气体336mL(已折算成标准状况),通入足量的氯水中,发生反应:SO2+Cl2+2H2O=H2SO4+2HCl。滴加足量BaCl2溶液,生成的沉淀经过滤、洗涤、干燥、称量,测得质量为2.330g。则混合气体中SO2的体积分数为___。(精确至小数点后第二位)
(5)将上述混合气体直接通入BaCl2溶液,未见明显现象,放置一段时间后发现有少许浑浊,分析其中的原因___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验中,所选装置或实验设计合理的是( )
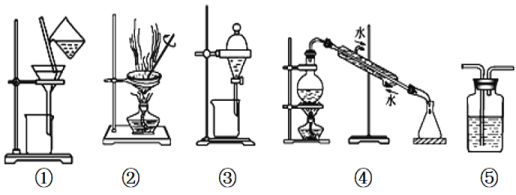
A.用图①和②所示装置可以除去NaCl中的CaCO3杂质,并获得NaCl固体
B.用乙醇提取溴水中的溴选择图③所示装置
C.用图④所示装置可以分离乙醇水溶液
D.图⑤所示装置中盛有饱和Na2CO3溶液除去CO2中含有的少量HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下,m g气体A与n g气体B的分子数目一样多,下列说法不正确的是( )
A. 在任意条件下,若两种分子保持原组成,则其相对分子质量之比为m∶n
B. 25 ℃、1.25×105 Pa时,两气体的密度之比为n∶m
C. 同质量的A、B在非标准状况下,其分子数之比为n∶m
D. 相同状况下,同体积的气体A与B的质量之比为m∶n
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 钠和冷水反应:Na+2H2O=Na++2OH+H2↑
B. 澄清石灰水与少量NaHCO3溶液混合:Ca2+ + OH-+ HCO3-![]() CaCO3↓+ H2O
CaCO3↓+ H2O
C. 向沸水中滴入适量的饱和氯化铁溶液;Fe 3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D. 碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3-+ OH-=CO32-+ H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列叙述中错误的是( )
①标准状况下,2.24L水中含有0.1 NA个水分子
②常温常压下,32gSO2 含有的分子数约为3.01×1023
③2 molNaOH的摩尔质量为80g/mol
④H2的气体摩尔体积约为22.4L/mol
⑤室温下,32gO2和O3的混合气体中含有的氧原子数为2NA
⑥2mol/L的CaCl2溶液中Cl-的数目为4NA
⑦常温常压下,1mol氦气含有的原子数为NA
⑧11.2L氯气中含有 NA个氯原子
⑨在标准状况下,22.4L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量为2mol
⑩标准状况下14gCO含有的核外电子数为10NA
A.①③④⑥⑧⑩B.①④⑤⑥⑧⑨
C.①②④⑥⑧⑨D.②③④⑤⑦⑩
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com