
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.23g钠所含的核外电子数为1.1NA
B.lLl![]() 乙醛溶液中含有分子的数目为NA
乙醛溶液中含有分子的数目为NA
C.4.48 L![]() 和CO混合气体完全燃烧,消耗的氧分子数目为 0.1NA
和CO混合气体完全燃烧,消耗的氧分子数目为 0.1NA
D.2.13 g氯气与足量热的NaOH溶液充分反应生成![]() 和
和![]() 时,转移的电子数目为0.05NA
时,转移的电子数目为0.05NA
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:还原性HSO3->I-,氧化性IO3->I2>SO42-,在含0.3molNaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )

A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3- ═3SO42-+I-+3H+
B.a点时消耗NaHSO3的物质的量为0.12mol
C.当溶液中的I-为0.04 mol时,加入的KIO3只能是0.04mol
D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
查看答案和解析>>
科目: 来源: 题型:
【题目】将铝粉和四氧化三铁粉末混合成铝热剂,平均分成两份。第一份在高温下二者恰好完全反应将生成物与足量的盐酸充分反应;第二份直接加入足量的氢氧化钠溶液使之充分反应。前后两种情况生成气体的物质的量之比
A.1:1B.3:2C.2:3D.3:4
查看答案和解析>>
科目: 来源: 题型:
【题目】将钠、铝混合物共1.0g投入适量水中充分反应,并测生成H2的量,若混合物中钠与铝的物质的量之比为x,如图为生成H2的物质的量随x的变化关系示意图(随着x的不断增大,产生H2的物质的量越来越接近b1).以下判断不正确的是 ( )

A.a1=![]() B.a2=1C.b1=
B.a2=1C.b1= ![]() D.b2=
D.b2=![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】醇酸树脂,附着力强,并具有良好的耐磨性、绝缘性等,在油漆、涂料、船舶等方面有很广的应用。下面是一种醇酸树脂G的合成路线:

已知:RCH2=CH2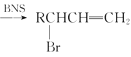
(1)反应①的反应条件为___________________,合成G过程中会生成另一种醇酸树脂,其结构简式为____________________________________
(2)反应②⑤反应类型分别为________、________;
(3)反应④的化学方程式为________;
(4)写出一种符合下列条件的F的同分异构体________。
a.1mol该物质与4mol新制氢氧化铜悬浊液反应
b.遇FeCl3溶液显紫色
c.核磁共振氢谱有3组峰值,比值为1:1:1
(5)设计由1一溴丙烷制备聚丙烯醇(![]() )的流程图:________。
)的流程图:________。
查看答案和解析>>
科目: 来源: 题型:
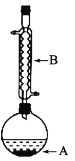
【题目】乙酸异戊酯是组成密蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
相对分子质量 | 密度/(g·cm3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1 .0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
实验步骤:在A中加入4.4g异戊醇![]() 、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液洗涤;分出的产物再加入少量无水Na2SO4固体,静止片刻。过滤除去Na2SO4固体,讲行蒸馏纯化。收集140~143°C馏分,得到乙酸异戊酯3.9g。回答下列问题:
、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液洗涤;分出的产物再加入少量无水Na2SO4固体,静止片刻。过滤除去Na2SO4固体,讲行蒸馏纯化。收集140~143°C馏分,得到乙酸异戊酯3.9g。回答下列问题:
(1)实验中制备乙酸异戊酯的化学方程式为_________________。
(2)仪器B的名称是_______________,作用是____________。
(3)在洗涤操作中饱和碳酸氢钠溶液的主要作用是______________。
(4)实验中加入少量无水Na2SO4的目的是_________________________。
(5)实验中加过量乙酸的目的是___________________________。
(6)本实验的产率是_______________(填标号)。
a.30% b.40% c.50% d.60%
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下列所给装置难以达到相应实验目的的是( )
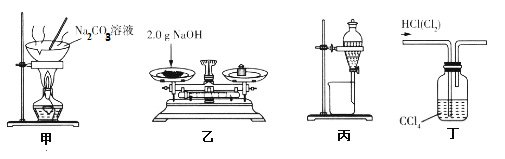
A.装置甲:蒸发结晶,制备纯碱
B.装置乙:称量,配制480 mL0. 10 mol·L-1 NaOH溶液,需称量2.0 g NaOH
C.装置丙:分液,四氯化碳萃取碘水中的I2后,分液获得碘的四氯化碳溶液
D.装置丁:洗气,除去HCl中Cl2杂质
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:

常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________。当试剂X是______时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________。
(4)写出用N2H4制备Cu2O的化学方程式:________,操作X包括_________、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是
A.在一定温度和压强下,各种气态物质体积大小由分子间距离决定
B.相同温度时,CO2和N2O若体积相同,则它们的质量一定相同
C.100g浓度为18mol/L的浓硫酸中加入等质量的水稀释浓度大于9mol/L
D.14 mol/L的H2SO4溶液的溶质质量分数为80%,那么7 mol/L的H2SO4溶液的溶质质量分数将大于40%
查看答案和解析>>
科目: 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种粒子。其中N2、ClO-的物质的量随时间变化的曲线如图所示。下列判断不正确的是
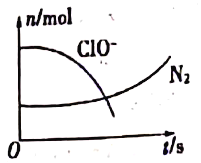
A. 该反应的氧化剂是ClO-
B. 消耗1mol还原剂,转移3mol电子
C. 氧化剂与还原剂的物质的量之比为2:3
D. 该离子方程式为3ClO-+2NH4+=2H++N2↑+3Cl-+3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com