
科目: 来源: 题型:
【题目】实验室中用下列装置测定SO2催化氧化为SO3的转化率(部分夹持装置已省略,已知SO3的熔点为16.8℃,假设气体进入装置时均被完全吸收,且忽略空气中CO2的影响),下列说法不正确的是( )
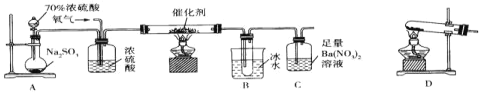
A.A装置烧瓶中发生的反应可以表示为SO32-+2H+=SO2↑+H2O
B.用D装置制备氧气,试管中的药品可以是KClO3
C.当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气
D.C中产生的白色沉淀是BaSO4
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,氧化反应与还原反应在同一元素间进行的是
A.Cl2 + 2NaOH = NaCl + NaClO + H2O
B.Fe + CuSO4 = FeSO4 + Cu
C.2KClO3 ![]() 2KCl + 3O2↑
2KCl + 3O2↑
D.2H2O ![]() 2H2↑+ O2↑
2H2↑+ O2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】3-甲基-3-羟甲基氧杂环丁烷 可用于制备多种化工原料。下列有关该有机物的说法正确的是( )
可用于制备多种化工原料。下列有关该有机物的说法正确的是( )
A.分子式为C4H8O2
B.与环氧乙烷(![]() )互为同系物
)互为同系物
C.与其互为同分异构体(不含立体结构)的羧酸有4种
D.分子中所有碳原子处于同—平面
查看答案和解析>>
科目: 来源: 题型:
【题目】NH4NO3 溶液受热可发生分解反应:NH4NO3![]() N2↑+HNO3+H2O(未配平)。用 NA 表示阿伏加德罗数的值,下列说法正确的是
N2↑+HNO3+H2O(未配平)。用 NA 表示阿伏加德罗数的值,下列说法正确的是
A.分解时每生成 2.24 L(标准状况)N2,转移电子的数目为 0.6NA
B.2.8 g N2 中含有共用电子对的数目为 0.3NA
C.56 g Fe 与足量稀硝酸反应生成 NO2 分子的数目为 3NA
D.0.1 mol·L-1 NH4NO3 溶液中,NH4+的数目小于 0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】2.0mol PC13和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应: PCl3(g)+Cl2(g) ![]() PCl5(g)达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.5mol Cl2,在相同温度下再达平衡时PCl3的物质的量是
PCl5(g)达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.5mol Cl2,在相同温度下再达平衡时PCl3的物质的量是
A.0.40molB.0.20mol
C.大于0.80mol,小于1.6molD.小于0.80mol
查看答案和解析>>
科目: 来源: 题型:
【题目】国际计量大会第26届会议新修订了阿伏加徳罗常数(NA=6.02214076×1023mol-1),并于2019年5月20日正式生效。下列说法中正确的是
A.12g金刚石中含有化学键的数目为4NA
B.将7.1g Cl2溶于水制成饱和氯水,溶液中Cl-、ClO-和HC1O的微粒数之和为0.1NA
C.标准状况下,11.2L NO和11.2L O2混合后,气体的分子总数为0.75NA
D.20g的D2O中含有的质子数为10NA
查看答案和解析>>
科目: 来源: 题型:
【题目】磷精矿湿法制备磷酸的一种工艺流程如下:

已知:磷精矿主要成分:Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
(1)上述流程中所采取的实验措施能加快反应速率有_____________。
(2)酸浸时,磷精矿中Ca5(PO4)3(OH)与H2SO4反应的化学方程式为_____________。
(3)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因______。

(4)脱硫时,CaCO3稍过量,充分反应后仍有SO42-残留,加入BaCO3代替CaCO3可进一步提高硫的脱除率,原因是_____。向粗磷酸中加入BaCO3脱硫,发生反应的离子方程式是_____。
(5)取ag所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L-1 NaOH 溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c L,精制磷酸中H3PO4的质量分数是_____。(已知摩尔质量为98g·mol-1)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是( )
A.20% NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度
B.200mL1 molL-1氯化钙溶液中c(C1-)和100 mL 2 molL-1氯化钾溶液中c(Cl-)
C.2mol水的摩尔质量和1 mol水的摩尔质量
D.64g二氧化硫中氧原子数和标准状况下22.4L一氧化碳中氧原子数
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E五种化合物均含有某种短周期常见元素,它们的转化关系如图所示,其中A的溶液为澄清溶液,C为难溶的白色固体,E易溶于水,取A的溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。

(1)写出化学式:A_______,B_______,C_______,D_______,E_______。
(2)写出下列反应的离子方程式:
A→B:_________________________________________________________;
A→D:__________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】锂电池具有能量密度大、质量轻、寿命长等诸多优点,被广泛应用于移动电话、笔记本电脑中。从某锂电池废料(主要成分为LiMn2O4,杂质为Fe、Cu等)中分离得到Li2SO4、MnCO3的一种工艺流程如图所示:

回答下列问题:
(1)研磨锂电池废料的主要目的是___________________。
(2)滤渣Ⅰ的主要成分为MnO2,写出向浆液中通入SO2发生反应的化学方程式:___________________。
(3)滤液Ⅰ中的金属阳离子有Cu2+、Fe3+和Li+,向滤液Ⅰ中加入氧化铜粉末的目的是___________________;向滤液Ⅱ中通入H2S发生反应的离子方程式为___________________。
(4)滤液Ⅲ经过操作Ⅰ后可得到Li2SO4,其中操作Ⅰ主要包括_____、_____、过滤、洗涤、干燥;在实验室中检验Li2SO4晶体是否洗涤干净的方法是__________。
(5)写出向MnSO4溶液中加入NH4HCO3生成MnCO3的化学方程式:___________________。
(6)现取18.1g该锂电池废料(LiMn2O4的质量分数为80.0%)模拟以上工艺流程进行实验,最终得到16.2gMnCO3,该实验中产率为_____(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com