
科目: 来源: 题型:
【题目】钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。预计在未来20年里,不可能有替代钕铁硼磁铁的磁性材料出现。生产钕铁硼磁铁的主要原材料有稀土金属钕、纯铁、铝、硼以及其它稀土原料。
(1) 钕(Nd)为60号元素,在元素周期表中的位置是_____;基态铁原子的外围电子排布图是______。
(2)实验测得气态A1C13的实际存在形式为A12C16双聚分子,其中A1原子的杂化方式是__________;A12C16与过量NaOH溶液反应生成Na[Al(OH)4];[A1(OH)4]-中存在的化学键有______(填选项字母)。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
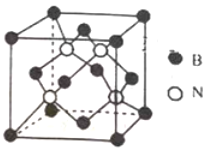
(3)已知立方BN晶体硬而脆,其原因是_______;其晶胞结构如图所示,N原子填充在B原子构成的正四面体空隙中,则晶胞中正四面体的空隙填充率为_______,设晶胞中最近的B、N原子之间的距离为a nm,晶体的密度为b gcm-3,则阿伏加德罗常数为_____mol-1 (列式即可,用含a、b的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值。下列判断正确的是( )
A.46g的NO2和N2O4的混合物所含原子总数为3NA
B.24g Mg变为Mg2+时失去的电子数目为NA
C.1mol/L CaCl2溶液中含有的Cl-离子数目为2NA
D.含有lmol FeCl3的溶液加热中完全转化为氢氧化铁胶体,其中胶粒的数目为NA个
查看答案和解析>>
科目: 来源: 题型:
【题目】欲配制100mL1.0 mol/L Na2SO4溶液,正确的方法是( )
①将14.2 g Na2SO4,溶于100mL水中
②将32.2g Na2SO410H2O溶于少量水中,再用水稀释至100 mL
③将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL
A.①②B.②③C.①③D.①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于Fe(OH)3胶体的叙述中,正确的是( )
A. 制备Fe(OH)3胶体的化学方程式是FeCl3+3H2O![]() Fe(OH)3↓+3HCl
Fe(OH)3↓+3HCl
B. 在制备Fe(OH)3胶体的实验中,加热煮沸时间越长,越有利于胶体的生成
C. Fe(OH)3胶体微粒能吸附阳离子,从而使Fe(OH)3胶体带有一定电荷
D. Fe(OH)3胶体能够吸附水中悬浮的固体颗粒并沉降,达到净水目的
查看答案和解析>>
科目: 来源: 题型:
【题目】一种通过铁基氧载体(Fe3O4/FeO)深度还原和再生来合成二甲醚(CH3OCH3) 的原理如图:
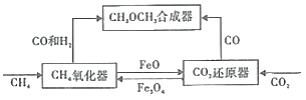
(1)二甲酸的合成反应:3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g);△H1
①已知CO、CH3OCH3与H2的燃烧热(△H)分别为 a kJ/mol、b kJ/mol、c kJ/mol(a、b、c均小于0),则△H1 ____kJ/moL。
②该反应选用(CuO/ZnO/Al2O)复合催化剂,该催化剂能_____(填标号)。
A.提高反应速率 B.促进平衡正向移动 C.改变反应的焓变 D.降低反应的活化能
(2)CH4氧化器中发生的主反应:
i.CH4(g)+Fe3O4(s)=CO(g)+2H2(g)+3FeO(s)
ii.CH4(g)+4Fe3O4(s)=CO2(g)+2H2O(g)+12FeO(s)
850℃时,压强和部分气体体积分数、固相各组分质量分数的关系如图。

①随着压强的增大,反应i的平衡常数K值________(填“增大”、“减小”或“不变”)。
②结合图像,分析H2O的体积分数变化的原因________(用化学方程式表示)。
(3)将一定量的FeO 和CO2置于CO2还原器(体积不变的密闭容器)中,发生的主反应:CO2(g)+3FeO(s)=Fe3O4(s)+CO(g)。保持其他条件不变,测得不同温度下最终反应体系中CO、CO2体积分数如下表。
温度t/℃ | 100 | 170 | 200 | 300 | 400 | 500 |
CO2体积分数 | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
CO体积分数 | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
①△H2______0(填“>”或“<”)。
②由上表可知,若在150℃时进行上述转化,理论转化率α(FeO)为100%。在上述反应体系中,一定可以说明该反应达到平衡状态的是______(填标号)。
A.CO2的物质的量不变
B.体系的压强不变
C.气体的平均摩尔质量不变
D.CO的生成速率和消耗速率相等且不等于零
③根据化学反应原理,分析CO2还原器温度设置在170℃的原因________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是( )
①标准状况下,1LHCl和1LH2O的物质的量相同;
②常温常压下,1gH2和14gN2的体积相同;
③28gCO的体积为22.4L;
④两种物质的物质的量相同,则它们在标准状况下的体积也相同;
⑤同温同体积时,气体的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比
A. ①③④⑥B. ②⑤⑥C. ⑤⑥D. ①⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】中国海军航母建设正在有计划、有步骤向前推进,第一艘国产航母目前正在进行海试。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为_______,铬元素在周期表中______区。
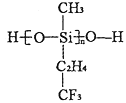
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为_______杂化。
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
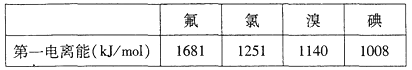
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是______填元素符号
②根据价层电子对互斥理论,预测ClO3-的空间构型为______形,写出一个ClO3-的等电子体的化学符号______。
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、铁、锰、锌等。如右图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?_____(填“是”或“否”);该立方体是不是Fe3O4的晶胞?______(填“是”或“否”);立方体中铁离子处于氧离子围成的_______(填空间结构)空隙;根据下图计算Fe3O4晶体的密度为________g/cm3。(图中a=0.42nm,计算结果保留两位有效数字)
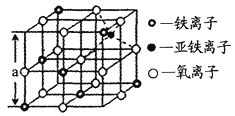
查看答案和解析>>
科目: 来源: 题型:
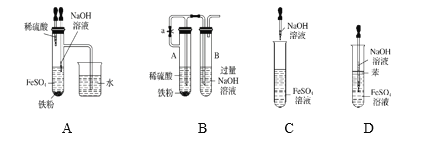
【题目】I.下列各图示中不能较长时间看到Fe(OH)2白色沉淀的是________(填序号)。
II.ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2,成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应:2NaClO2+Cl2=2ClO2+2NaCl。下图是实验室用于制备和收集一定量纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)。
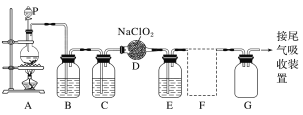
(1)仪器P的名称是________________。
(2)写出装置A中烧瓶内发生反应的离子方程式:______________________________。
(3)B装置中所盛试剂是________________。
(4)F为ClO2收集装置,应选用的装置是________(填序号),其中与E装置导管相连的导管口是________(填接口字母)。
III.如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。

现欲用该浓硫酸配制成1mol/L的稀硫酸,现实验室仅需要这种稀硫酸220mL。试回答下列问题:
(1)用量筒量取该浓硫酸____________mL。
(2)配制时,必须使用的仪器除量筒、烧杯、玻璃棒外,还缺少的仪器是____。
(3)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是__________。
A.用量筒量取浓硫酸时俯视
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切
E.容量瓶不干燥
F.定容时,仰视容量瓶刻度线
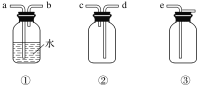
(4)某同学用固体Na2CO3配制500 mlL 0.1molL-1溶液的过程如图所示:
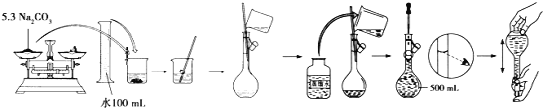
你认为该同学的错误步骤有__________处。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D四种元素,A元素的原子有三个电子层,最外层上有一个电子;B元素负2价阴离子的电子层结构与氩原子相同;C元素的原子核内无中子;D原子核外电子数比A原子核外电子总数多6个。
(1)C与D形成化合物的化学式_______,其在水中的电离方程式为_______________。
(2)B离子的结构示意图_____________________。
(3)D元素在周期表中的位置_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com