
科目: 来源: 题型:
【题目】下列对化学用语的理解正确的是( )
A.键线式H-C1-O可以表示次氯酸分子的结构
B.电子式![]() 可以表示氢氧根离子,也可以表示羟基
可以表示氢氧根离子,也可以表示羟基
C.结构示意图 可以可以表示35Cl-,也可以表示37Cl-
可以可以表示35Cl-,也可以表示37Cl-
D.比例模型![]() 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是()
A.常温常压下,23 g NO2和N2O4的混合气体一定含有含有NA个氧原子
B.1 L 0.1 mol/L NaHSO4溶液中含有0.1 NA个![]()
C.将0.1 mol NaCl全部溶于乙醇中制成胶体,其中含有的胶体粒子数目为0.1 NA
D.1 mol Cl2与足量的NaOH溶液发生反应:Cl2+2NaOH=NaClO+NaCl+H2O,转移2NA个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制备溴苯的反应装置如图所示,回答下列问题:
已知:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
水中的溶解度 | 微溶 | 微溶 | 微溶 |
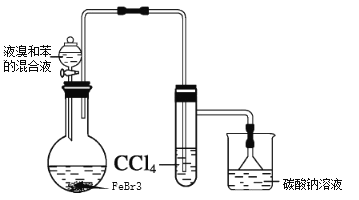
(1)实验装置c的作用为_______。
(2)写出实验室制备溴苯的反应方程式_______。
(3)本实验得到粗溴苯后,除去铁屑,再用如下操作精制:a蒸馏;b水洗;c用干燥剂干燥;d 10%NaOH溶液洗涤;e水洗,正确的操作顺序是________。
(4)本实验使用6mL无水苯、4.0mL液溴和少量铁屑,充分反应,经精制得到6.5mL的溴苯。则该实验中溴苯的产率是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列为某学生在实验室中制备高锰酸钾晶体的流程图。
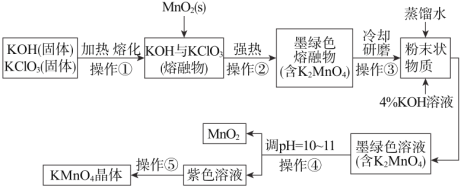
根据上图回答下列问题:
(1)操作①和②均需在坩埚中进行,根据实验实际应选择坩埚为_____(填字母);
a.石英坩埚 b.氧化铝坩埚 c.铁坩埚
(2)已知:3MnO42-+2H2O2MnO4-+MnO2+4OH-。操作④中通CO2调pH=10~11,其目的是_____;
(3)得到墨绿色溶液后,也可用如图所示方法制备KMnO4,电极均为铂电极。
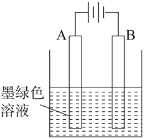
①A极上的电极反应式为_____;
②这种方法与上面的方法相比,其优点是_____;
(4)实验室中,可用0.10mol/L,草酸作标准溶液,利用下述反应,测定所得KMnO4晶体的纯度。5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O
取agKMnO4晶体样品配制成100mL溶液。每次取20.00mL于锥形瓶中进行滴定实验两次。两次实验所用草酸标准溶液的体积分别为22.15mL和22.17mL,由此求得KMnO4晶体的纯度为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有NaCl、Na2SO4.和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。
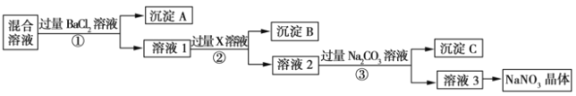
请回答下列问题:
(1)产生沉淀A的离子反应方程式是:________________________;
(2)试剂X是:____________________________________;
(3)上述实验流程中①②③步骤中均要用到的主要玻璃仪器有____________;
(4)上述实验流程中加入过量Na2CO3溶液产生的沉淀C是:________________________。
(5)按此实验方案得到的溶液3中肯定含有杂质,为了解决这个问题,可以向溶液3中加入适量的____________ (填化学式),并写出离子反应方程式:_______________________________________________。
(6)溶液3到硝酸钠晶体需要的操作步骤是:________________________洗涤,干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】青金石是碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氧、氧等元素,曾用来制作颜料。
(1)在周期表中,与Si的化学性质最相似的邻族元素是_________。
(2) Na+和 Ne互为等电子体,电离能 I2(Na)_________I1(Ne)填"〉”或“<")。
(3)已知氯、硫有多种含氧酸,HClO4中共价键类型有_____,硫酸的结构式为_____。
(4)氢卤酸(HX)的电离过程如图。△H1和△H2的递变规律:HF > HCl> HBr >HI,其中△H1(HF)特别大的原因为________,影响△H2递变的因素为________。

查看答案和解析>>
科目: 来源: 题型:
【题目】根据物质的量的相关公式计算:
(1)16gO3和16g O2分子数之比为________,含氧原子数之比为________;
(2)12.7g FeCl2固体溶于水配成500mL溶液,其浓度为________molL-1,从该溶液中取出100mL溶液,其中C1-的浓度为________molL-1;
(3)某金属氯化物MCl227g,含有0.40 mol Cl-,则该氯化物的物质的量为________,M的摩尔质量为________。
(4)下列数量的各物质所含原子数按由大到小的顺序排列的是____________。
①34g氨气 ②标准状况下44.8L氦气 ③25°C时18 mL水 ④0.5 mol H2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:

(1)指出提取碘的过程中有关的实验操作名称:①________,③________;
(2)操作③中所用的有机试剂可以是________;
A.乙醇 B.四氯化碳 C.乙酸 D.汽油
(3)已知操作步骤②中得到的“含碘水溶液中有Cl-离子存在,写出该步骤的离子反应:___________________________________________;
(4)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察如图所示实验装置,指出仪器N的名称是:________________________,装置中有典型两处错误,加以改正:①________________________,②_______________________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A.澄清石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O
B.氯气通入到FeCl2溶液中:Fe2++Cl2=Fe3++2Cl-
C.稀硫酸与氢氧化钡溶液反应:H++OH-+Ba2++![]() =H2O+BaSO4↓
=H2O+BaSO4↓
D.碳酸氢钠溶液与氢氧化钾反应:HCO3-+OH-=H2O+![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】近年研究表明离子液体型催化剂GIL可对某些特定加成反应有很好的催化作用,有机化合物H的合成路线如下:
(1) C中含有的官能团名称为______________。
(2) C—D的反应类型为______________。
(3)已知:G和H的分子式相同,F→G和B→C反应类型均为消去反应,那么G的结构简式为______________。
(4)写出满足下列条件的B的一种同分异构体X的结构简式: ______________。
①1 mol X完全水解消耗2 mol NaOH;
②水解酸化后两种产物核磁共振氢谱均有4个峰,峰高比为3:2:2:1。
X在酸性条件下发生水解反应的产物名称为_________。
(5)以乙醇为原料利用GIL合成聚酯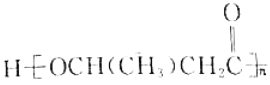 写出合成路线流程图(无机试剂可任选,合成路线流程图示例见本题题干)______________。
写出合成路线流程图(无机试剂可任选,合成路线流程图示例见本题题干)______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com