
科目: 来源: 题型:
【题目】常温下,向 20 mL 0.2 mol/LH2A溶液中滴加0. 2 mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示(其中I代表H2A.,II代表HA—,III表A2—)。根据图示.判断下列说法正确的是

A.当V(NaOH)=20 mL时.溶液中各离子浓度的大小关系为c(Na+)>c(HA—)>c(H+)>c(A2一)>c(OH—)
B.等体积、等物质的量浓度的NaOH溶液与H2 A溶液混合后,其溶液中水的电离程度比纯水中的大
C.NaHA溶液中:c(OH—)+2c(A2—) =c(H+) +c(H2A )
D.将Na2A溶液加水稀释.溶液中所有离子的浓度都减小.但部分离子的物质的量增加
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:![]() 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y﹤zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数升高
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是()
A.NH4HCO3溶液与过量KOH浓溶液共热:![]() + OH-
+ OH-![]() NH3↑+ H2O
NH3↑+ H2O
B.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性: Ba2++ OH- + H+ +![]() = BaS04↓+ H2O
= BaS04↓+ H2O
C.醋酸铅溶液通入硫化氢气体的反应:Pb(CH3COO)2 + H2S = PbS + 2CH3COOH
D.向NaAlO2溶液中通入过量CO2:2![]() + CO2 + 3H2O = 2Al(OH)3↓+
+ CO2 + 3H2O = 2Al(OH)3↓+ ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2、NO是大气污染物,NH4NO3、H2SO4等是水体污染物,有效去除这些污染物是一项重要课题。
(1)NO、SO2可以先氧化,后用碱吸收。其氧化过程的反应原理如下:
NO(g)+O3(g)NO2(g)+O2(g) H1=-200.9kJ/mol
SO2(g)+O3(g) SO3(g)+O2(g) H2=-241.6kJ/mol
2SO2(g)+O2(g) 2SO3(g) H3=-196.6kJ/mol
则反应2NO2(g) 2NO(g)+O2(g)的H=___kJ/mol
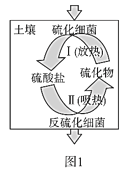
(2)土壤中的硫循环如图1所示。
①土壤中的黄铁矿(FeS2)在过程I中会转化成硫酸亚铁和硫酸。该过程发生反应的化学方程式为_____;
②某种反硫化细菌在过程II中需要有乳酸参与反应消耗硫酸生成H2S并伴有热量放出,那么乳酸除在反应中作还原剂外,还存在另一作用,请解释原因:_____;
(3)电解法除去工业废水中的硝酸铵的装置示意图如图2所示,阴极电极反应式为____;

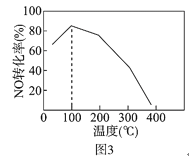
(4)向恒容密闭容器中充入1molNO和2molO3,发生如下反应:NO(g)+O3(g) NO2(g)+O2(g) △H<0不同温度下反应相同时间后,体系中NO转化率随温度变化曲线如图3。温度低于100℃时,NO转化率随温度升高而增大的主要原因是_____;当温度高于100℃时,NO转化率随温度升高而降低,原因是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】聚碳酸酯(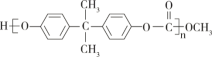 )的透光率良好。它可制作车、船、飞机的挡风玻璃,以及眼镜片、光盘、唱片等。它可用绿色化学原料X(
)的透光率良好。它可制作车、船、飞机的挡风玻璃,以及眼镜片、光盘、唱片等。它可用绿色化学原料X(![]() )与另一原料Y反应制得,同时生成甲醇。下列说法不正确的是
)与另一原料Y反应制得,同时生成甲醇。下列说法不正确的是
A. Y的分子结构中有2个酚羟基 B. Y的分子式为C15H18O2
C. X的核磁共振氢谱有1个吸收峰 D. X、Y生成聚碳酸酯发生的是缩聚反应
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是
A. 11.2 L 甲烷和乙烯的混合物中含氢原子数目等于2NA
B. 含NA个 CO32-的 Na2CO3溶液中,Na+数目大于2NA
C. 密闭容器中,2 molSO2和足量 O2充分反应,产物的分子数小于2NA
D. 4.0 g CO2气体中含电子数目等于2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、 Cu2 (OH)2 CO3等杂质]为原料制取二氧化锰.其工艺流程示意图如下图所示:

已知生成氢氧化物沉淀的pH如下表所示:
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度均为0.1mol·L—1
请回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是__________;盐酸溶解MnCO3的化学方程式是____________________________。
(2)向溶液1中加入双氧水时.发生反应的离子方程式是_________________。
(3)向滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,发生反应的离子方程式是_________________________。
(4)将MnCl2转化为MnO2的一种方法是氧化法。其具体做法是用酸化的NaClO3溶液将MnCl2氧化,请完成该反应的离子方程式:5Mn2++2ClO3—+____===____+_____+_____。
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是______________________。
②若在上述MnO2溶液中加入一定量的Mn(NO3 )2粉末.则无Cl2产生.其原因是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是( )
A.图甲表示2SO2(g)+O2(g)2SO3(s)△H<0,t1时改变的条件是增大体系的压强
B.图乙NaCl溶液浓度过高铁腐蚀速率降低,说明NaCl浓度越大溶液中O2的浓度越小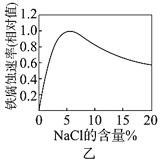
C.图丙说明石墨转化为金刚石的反应的△H>0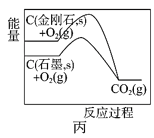
D.图丁是一定条件下发生反应:4NH3+4NO+O24N2+6H2O,此过程△H<0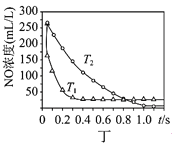
查看答案和解析>>
科目: 来源: 题型:
【题目】从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲的一种工艺流程如图:(已知TeO2微溶于水,易溶于强酸和强碱) 下列有关说法正确的是
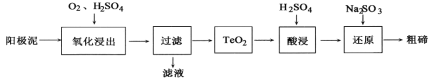
A. “氧化浸出”时为使碲元素沉淀充分,应加入过量的硫酸
B. “过滤”用到的玻璃仪器:分液漏斗、烧杯、玻璃棒
C. “还原”时发生的离子方程式为2SO32-+Te4++4OH-=Te↓+2SO42-+2H2O
D. 判断粗碲洗净的方法:取少量最后一次洗涤液,加入BaCl2溶液,没有白色沉淀生成
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化:
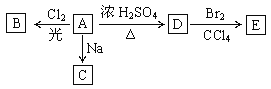
①A分子中的官能团名称是_______。A的同分异构共有_________种(包括A本身)
②A只有一种一氯取代物B。写出由A转化为B的化学方程式:_________________。
③A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种。则F的结构简式是____________。
(2)化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与三氯化铁溶液发生显色反应。“HQ”还能发生的反应是(填序号)_________
① 加成反应 ②氧化反应 ③加聚反应 ④水解反应
“HQ”的一硝基取代物只有一种。“HQ”的结构简式是______________。
(3)A和“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ”。“TBHQ”与氢氧化钠溶液作用得到化学式为C10H12O2Na2的化合物。“TBHQ”的结构简式是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com