
科目: 来源: 题型:
【题目】高铁酸钾的生产流程如图,涉及的离子反应方程式书写错误的是( )
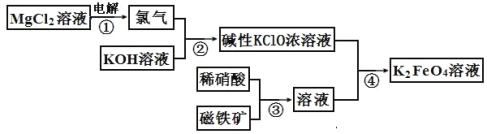
A. 2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B. Cl2+2OH-=Cl-+ClO-+H2O
C. 3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
D. 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】 (15分)研究证明,高铁酸钾不仅能在饮用水源和废水处理过程中去除污染物,而且不产生任何诱变致癌的产物,具有高度的安全性。湿法制备高铁酸钾是目前最成熟的方法,实验步骤如下:
A.直接用天平称取60.5gFe(NO3)3·9H2O、30.0gNaOH、17.1gKOH。
B.在冰冷却的环境中向NaClO溶液中加入固体NaOH并搅拌,又想其中缓慢少量分批加入Fe(NO3)3·9H2O,并不断搅拌。C.水浴温度控制在20℃,用电磁加热搅拌器搅拌1.5h左右,溶液成紫红色时,即表明有Na2FeO4生成。
D.在继续充分搅拌的情况下,向上述的反应液中加入固体NaOH至饱和。
e.将固体KOH加入到上述溶液中至饱和。保持温度在20℃,并不停的搅拌15min,可见到烧杯壁有黑色沉淀物生成,即K2FeO4.
(1)①步骤b中不断搅拌的目的是_______。②步骤c中发生反应的离子方程式为______。③由以上信息可知:高铁酸钾的溶解度比高铁酸钠_______(填“大”或“小”)。
(2) 高铁酸钾是一种理想的水处理剂,与水反应生成O2、Fe(OH)3(胶体)和KOH。① 该反应的离子方程式为______。②高铁酸钾作为水处理剂发挥的作用是_______。③ 在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______。
A.H2O B.稀KOH溶液、异丙醇 C.NH4Cl溶液、异丙醇 D.Fe(NO3)3溶液、异丙醇
(3) 高铁酸钠还可以用电解法制得,其原理可表示为Fe+2NaOH+2H2O![]() 3H2↑+Na2FeO4,则阳极材料是____,电解液为______。
3H2↑+Na2FeO4,则阳极材料是____,电解液为______。
(4)25℃时,Ksp(CaFeO4)=4.536×10-9,若要使100mL1.0×10-3mol/L的K2FeO4溶液中的c(FeO42-)完全沉淀,理论上要加入Ca(OH)2的物质的量为_____mol。
(5)干法制备高铁酸钾的方法是Fe2O3、KNO3、KOH混合加热共熔生成黑色高铁酸钾和KNO2等产物。则该方法中氧化剂与还原剂的物质的量之比为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷酸二氢钾(KH2PO4)在工业、农业、医药及食品等行业均有广泛的应用。利用氟磷灰石(化学式为Ca5P3FO12)制备磷酸二氢钾的工艺流程如图所示(部分流程步骤已省略):

其中,萃取是因为KCl和H3PO4产生的HCl易溶于有机萃取剂。请回答下列问题:
(1)氟磷灰石(Ca5P3FO12)中磷元素的化合价是____。
(2)用化学反应原理解释KCl和H3PO4生成KH2PO4的原因: ________。
(3)沸腾槽不能采用陶瓷材质的原因是_______(用化学方程式表示)。
(4)在得到N的流程中“……”的操作步骤是______、洗涤、干燥。
(5)在萃取过程中,影响萃取率的因素复杂,下图是投料比![]() 对萃取率的影响曲线,在实际操作中,应选择投料比
对萃取率的影响曲线,在实际操作中,应选择投料比![]() 的范围是___(填序号)。
的范围是___(填序号)。

A.0.2~0.4 B.0.4~0.6 C.0.6~0.8 D.0.8~1.0 E.1.0~1.2
(6)电解法制备KH2PO4是用石墨作电极,将电解槽分为a区和b区,中间用阳离子交换膜隔离,a区为3 mol·L-1 H3PO4,b区为3 mol·L-1 KCl。阳极区为____(填“a”或“b”)区,其电极反应式是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氟的单质及含氟化合物用途非常广泛。回答下列问题:
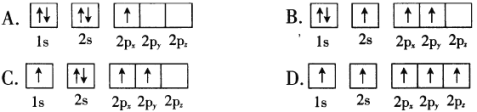
(1)BF3常用作有机反应的催化剂,下列B原子电子排布图表示的状态中,能量最低和最高的分别为____________、_______________。(填标号)
(2)NH4HF2(氟氢化铵)固态时包含的作用力有_______________(填标号)。
a.离子键 b.![]() 键 c.
键 c.![]() 键 d.氢键
键 d.氢键
(3)由反应2F2+2NaOH=OF2+2NaF+H2O可制备OF2。OF2的空间构型为___________,氧原子的杂化方式是_____________________________
(4)CsF是离子晶体,其晶格能可通过图(a)的born-Haber循环计算得到。
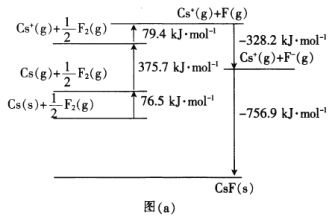
由图(a)可知,Cs原子的第一电离能为_______________________kJ·mol-1,F-F键的键能为________kJ·mol-1,CsF的晶格能为________kJ·mol-1。
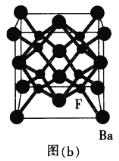
(5)BaF2晶胞是一种良好的闪烁晶体[如图(b)所示]。Ba2+的配位数为_________个;已知其密度为![]() ,则BaF2的晶胞参数为a=____________(设NA为阿伏加德罗常数的数值,列出计算式) nm。
,则BaF2的晶胞参数为a=____________(设NA为阿伏加德罗常数的数值,列出计算式) nm。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)甲醇一空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图甲所示,该电池中正极的电极反应式为_____。
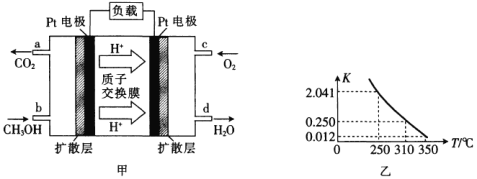
(2)工业上合成甲醇一般采用下列反应:![]() ,
,![]() ,图乙是该反应在不同温度下的化学平衡常数(K):
,图乙是该反应在不同温度下的化学平衡常数(K):
①由图中数据判断a_______0(填“>”“=”或“<”)。
②某温度下,将2molCO和6molH2充入2L的恒容密闭容器中,充分反应达到平衡后,测得c(CO)=0.5mol·L-1,则此时的温度为________℃。
(3)T℃时,在恒容密闭容器中发生反应:![]() ,各物质的浓度变化如图丙所示:
,各物质的浓度变化如图丙所示:
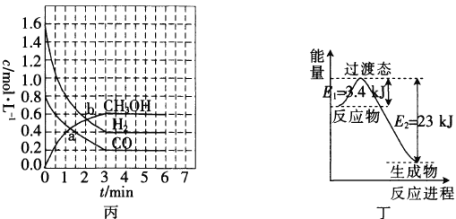
①反应从0min到3min之间,CH3OH的反应速率为________________。
②CO在0~1min和1~3min时平均反应速率[平均反应速率分别以v(0~1),v(1~3)表示]的大小为_____________________________。
(4)目前工业上有一种方法是用CO2和H2在230℃、催化剂条件下转化生成甲醇蒸气和水蒸气。图丁表示恒压容器中0.5molCO2和1.5molH2反应时转化率达80%的能量变化示意图。写出该反应的热化学方程式:_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以废铜为原料经一系列化学反应可生产氯化亚铜(CuCl),其工艺流程如下图所示:

试依据如图转化回答下列问题:
(1)工业生产Cl2时,尾气常用石灰乳吸收,而不用烧碱溶液吸收的原因是_______。
(2)还原过程中的产物为Na[CuCl2],试写出该反应的化学方程式:___________。
(3)合成结束后所得产品用酒精淋洗的目的是_______________。
(4)实验室中在CuCl2热溶液中通入SO2气体也可制备白色的CuCl沉淀,试写出该反应的离子方程式:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向0.1mol/L的AlCl3溶液中不断加入NaOH溶液,体系中含铝微粒的分布分数随溶液pH的变化如图所示。下列说法错误的是
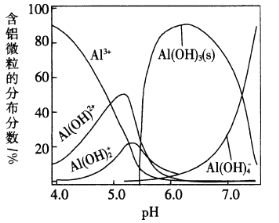
A.pH=4的溶液中:c(Al3+)>c[Al(OH)2+]>c[Al(OH)2+]
B.pH=4.5的溶液中:c(H+)+3c(Al3+)+2c[Al(OH)2+]+c[Al(OH)2+]=c(Cl-)+c(OH-)
C.pH=7时,向体系中再加入NaOH溶液,主要发生的离子反应为Al(OH)3+OH-=Al(OH)4-
D.pH=8时,向得到的溶液中通入CO2至饱和,主要发生的离子反应为2Al(OH)4-+CO2=2Al(OH)3↓+CO32-+H2O,CO32-+CO2+H2O=2HCO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】将某浅黄色固体(由X、Y两种元素组成)和焦炭混合,加热,发生反应,其装置如图所示。先通入氮气,再点燃I、Ⅲ中的酒精灯,实验中观察到I中生成银白色金属,Ⅱ、Ⅳ中溶液变浑浊、Ⅲ中黑色粉末变成红色。下列叙述不正确的是
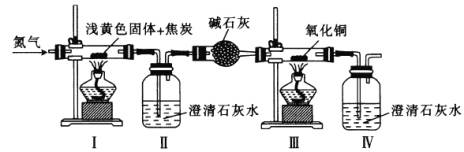
A.X可能是钠元素,Y一定是氧元素
B.浅黄色固体与焦炭在高温下反应生成CO2和CO
C.先通入氮气的目的是排尽装置中的空气
D.用燃烧法处理Ⅳ排放的尾气
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(部分产物已略去)。下列说法正确的是( )
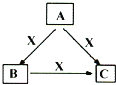
A. 若X为KOH溶液,则A可能为Al
B. 若X为Fe,则C可能为Fe(NO3)2溶液
C. 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2
D. 若X为O2,则A可为有机物乙醇,也可为非金属单质硫
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,pH=2的两种一元酸x和y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示。分别滴加NaOH溶液至滴定终点,消耗NaOH溶液的体积为Vx、Vy,则

A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com