
科目: 来源: 题型:
【题目】反应2NO2(g)![]() N2 O4(g);△H= -57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
N2 O4(g);△H= -57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
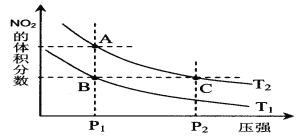
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A浅,C深
C.由状态A到状态B,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中,反应aA(g)![]() bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了
B.物质B的质量分数减小了
C.物质A的转化率减小了
D.a>b
查看答案和解析>>
科目: 来源: 题型:
【题目】同温同压下,xg的甲气体和yg的乙气体占有相同的体积,根据阿伏加德罗定律判断,下列叙述错误的是
A.甲与乙的相对分子质量之比等于x:y
B.等质量的甲与乙的分子个数之比等于x:y
C.同温同压下甲与乙的密度之比等于x:y
D.同温同体积下等质量的甲与乙的压强之比等于y:x
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.硫化钠水解:S2-+2H2O=H2S+2OH-
B.强碱溶液吸收工业制取硝酸产生的尾气:NO2+2OH-=2NO2-+H2O
C.醋酸与氨水混合:CH3COOH+NH3·H2O=CH3COONH4+H2O
D.向 NaAlO2溶液中通入少量CO2:2A1O2-+CO2+3H2O=2A1(OH)3↓ +CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】若NA表示阿伏加德罗常数的值,下列说法正确的是
A.1mol OH﹣含有的电子数为9NA
B.标准状况下,NO2和N2O4的混合物23g中含有NA个氧原子
C.常温常压下,2.8gN2和2.24L CO所含电子数均为1.4NA
D.标准状况下,22.4 L 乙醇中含有NA个乙醇分子
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-905.9kJ·mol-1。下列叙述正确的是
4NO(g)+6H2O(g) △H=-905.9kJ·mol-1。下列叙述正确的是
A.4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ
B.平衡时,5v正(O2)=4v逆(NO)
C.平衡后降低压强,混合气体平均摩尔质量增大
D.平衡后升高温度,混合气体中NO含量降低
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的有几个 ( )
①重水的化学式为T2O
②CO2的比例模型:![]()
③H2O2的电子式:![]()
④硅酸盐Ca2 Mg5 Si8 O22(OH)2可用氧化物形式表示为:2CaO﹒5MgO﹒8SiO2 ﹒H2O
⑤硅胶有吸水性,是常用的食品干燥剂
⑥医疗上常用乙醇体积分数为95%的酒精杀菌消
⑦聚四氟乙烯耐酸碱腐蚀,可用作化工反应器的内壁涂层
⑧水中的钢闸门连接电源的负极属于牺牲阳极的阴极保护法
⑨食盐可作调味剂,也可作食品防腐剂
A.1B.2C.3D.4
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:
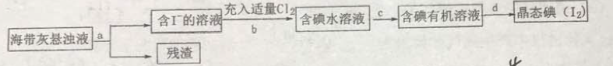
(1)指出提取碘的过程中有关的实验操作名称:a__________,c__________。
(2)操作c需要的仪器是__________,所用的有机试剂可以是CCl4,简述选择理由__________;最后碘的CCl4溶液是通过__________获得(填“漏斗上口”或“漏斗下口”)。
(3)从含碘的有机溶液中提取碘和回收有机溶液CCl4,还需要经过__________,观察下图所示实验装置,指出仪器名称b__________,冷却水从__________进入(填A或B),最后碘留在__________里。(填仪器名称)
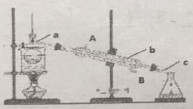
查看答案和解析>>
科目: 来源: 题型:
【题目】在可逆反应:2A(g)+3B(g)![]() xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法正确的是( )
xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法正确的是( )
A. 2min末时A和B的浓度之比为5:3
B. x=1
C. 2min末时B的浓度为1.5mol/L
D. 2min末时A的消耗浓度为0.5mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】下面为甲、乙、丙三位同学制取乙酸乙酯的实验过程。
(实验目的)制取乙酸乙酯。
(实验原理)甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。
1.(装置设计)甲、乙、丙三位同学分别设计了下列三套实验装置:
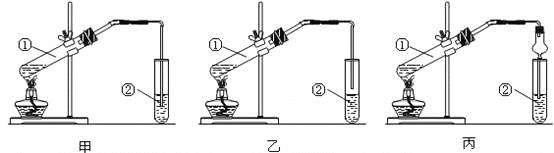
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,不应选择的装置是____(填“甲”或“乙”)。丙同学装置中的球形干燥管,除起冷凝作用外,另一重要作用是______。
2.(实验步骤)
(1)按选择的装置组装仪器,在试管中先加入amLCH3CH218OH(密度为ρg/cm-3)和过量的冰醋酸(CH3COOH),并边振荡边缓缓加入2mL浓H2SO4;
(2)将试管固定在铁架台上;
(3)在试管②中加入适量的饱和Na2CO3溶液;
(4)用酒精灯对试管①加热;
(5)当观察到试管②中有明显现象时认为反应基本完成。
(问题讨论)
a.按步骤(1)装好实验装置,加入药品前还应______。
b.在(5)中,当观察到试管②中有______现象时认为反应基本完成。
c.分离试管②中的混合物可以得到产品及回收未反应的乙酸和乙醇,实验操作流程如下:
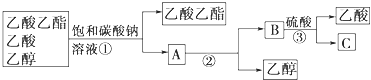
在上述实验操作流程中,所涉及的①②③三次分离操作分别是:______。
d.已知在酸与醇的酯化反应中,反应的原理是酸失去羟基,醇失去氢原子结合成水。请写出试管①中生成乙酸乙酯反应的化学方程式(注明反应条件)_____________。
最后得到纯净的乙酸乙酯bg,求本实验中乙酸乙酯的产率:______(用a、b、ρ表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com