
科目: 来源: 题型:
【题目】化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是( )

A. 分子中两个苯环一定处于同一平面
B. 不能与饱和Na2CO3溶液反应
C. 在酸性条件下水解,水解产物只有一种
D. 1mol化合物X最多能与1 molNaOH反应
查看答案和解析>>
科目: 来源: 题型:
【题目】甲是一种盐,由A、B、C、D、E五种短周期元素元素组成。甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
③取少量甲溶液于试管中,向其中加入稀盐酸,再加入BaCl2溶液,出现白色沉淀;
③取少量甲溶液于试管中逐滴滴入NaOH溶液,生成沉淀的质量与滴入NaOH溶液的体积关系如下图所示,

④取少量甲溶液于试管中,加入过最的NaOH溶液并加热。
回答下列问题:
(1)C的元素符号是_______,D在周期表中的位置是________。
(2)经测定甲晶体的摩尔质量为453 gmol-1,其中阳离子和阴离子物质的量之比为1:1,则甲晶体的化学式为________。
(3)实验③中根据图象得V(oa):V(ab):V(bc)= _______。
(4)实验④中离子方程式是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】海冰是海水冻结面成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包围在冰晶之间,形成“盐泡”,其大致结钩如图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是

A.海冰内层“盐泡”越多,密度越小
B.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
C.海冰内层NaCl的浓度约为10-4mol/L(设冰的密度为0.9g/cm3)
D.海冰冰龄越长,内层的“盐泡”越多
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用氧化铝基废催化剂(主要成分为Al2O3,还含有少量Pd(钯)))回收硫酸铝及Pd的流程如下:

回答下列问题:
(1)将硫酸铝溶液蒸发浓缩后,冷却得到十八水合硫酸铝固体,该固体的化学式为___。
(2)焙烧时Al2O3与(NH4)2SO4反应的化学方程式为___。
(3)王水是浓硝酸和浓盐酸按体积比为___的混合物。王水不稳定,加热时能生成亚硝酰氯(NOCl)和氯气,该反应的化学方程式为___。
(4)浸液Y中含Pd元素的溶质是H2PdCl6(氯钯酸),则“酸浸”时反应的化学方程式为___。
(5)若“热还原”中得到的固体只有Pd,每生成1molPd时生成的气体的物质的量为___。
(6)Pd是优良的储氢金属,其储氢原理为2Pd(s)+xH2(g)═2PdHx(s),其中x的最大值为0.8。已知:Pd的密度为12gcm﹣3,则21.2cm3Pd能储存标准状况下H2的最大体积为___L。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知有以下物质相互转化:
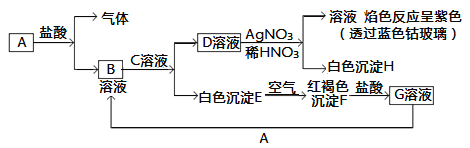
试回答:
(1)写出B的化学式________,D的化学式________。
(2)写出由E转变成F的化学方程式________________________。
(3)写出用KSCN鉴别G溶液的离子方程式________________;向G溶液加入A的有关离子反应方程式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】加碘食盐是含KIO3的食盐,其中KIO3可由反应KI+3Cl2+3H2O=KIO3+6HCl制取。市面上销售的加碘食盐中的碘元素含量为20~50mg/kg。请计算:制取1000kg含碘元素25.4mg/kg的加碘食盐,需要消耗Cl2的体积是多少___?(标准状况)
查看答案和解析>>
科目: 来源: 题型:
【题目】制烧碱所用的盐水需进行两次的精制。
(1)第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42-等离子,过程如下:
I.向粗盐水中加入过量X,过滤。
II.向所得滤液中加入过量Y,过滤。
III.滤液用盐酸调节pH,获得一次精制盐水。
请回答下列问题:
①X是__________。
②Y是___________,加入Y的主要目的_______________。
③经检测,II中过滤所得的沉淀中还含有Mg2(OH)2CO3,生成该沉淀的离子方程式是________。
(2)第二次精制要除去一次精制盐水中微量的IO3-、NH4+、Ca2+、Mg2+,流程示意图如下:

①IV中除去的离子是____________(填化学式),判断的理由是_______。
②V中得到的溶液颜色呈棕黄色,由此说明Na2S2O3将IO3-还原为______(填化学式),同时Na2S2O3被氧化为SO42-。此反应中体现了Na2S2O3的_________性。假设Na2S2O3已完全反应,则证明盐水b中含有SO42-的方法是__________,观察到的现象是____________。
③有同学提出,该流程中的过程IV可直接加入NaOH溶液除去NH4+和Mg2+,你认为是否可行?_______(填“是”或“否”,提示NH3极易溶于水),理由是_______(答一点)。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有0.5L某泉水样品,其中含有Ca2+0.02g,请计算:
(1)该泉水样品中Ca2+的物质的量浓度是多少___?
(2)为使该泉水样品中所含的Ca2+全部沉淀,至少应加入Na2CO3的物质的量是多少___?
查看答案和解析>>
科目: 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:

依据上图,完成下列填空:
(1)从海水中获取粗盐的方法是___。
(2)“精制”工序中,欲除去粗盐水中的Ca2+、Mg2+及SO42-,可进行的操作有:
A. 过滤
B. 加过量BaCl2溶液
C. 加适量稀盐酸
D. 加过量NaOH溶液
E. 加过量Na2CO3溶液
①正确操作的顺序是___(填字母)。
②操作B的目的是___
③操作C的目的是___
④操作D中发生反应的离子方程式是___
⑤此操作中的稀盐酸能否用稀硝酸代替?____(填“能”或“否”),理由是___。
(3)检验“电解”后的溶液中仍然含有NaCl的方法是___,观察到的现象是___。
(4)“脱盐“工序中,通过加热浓缩、冷却结晶、___的方法除去NaCl,该方法的原理是相同温度下NaCl与NaOH的溶解度不同,在该操作温度下,溶解度较大的是___。
(5)上述工艺中可循环使用的物质是______。(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com