
科目: 来源: 题型:
【题目】过氧化钙是一种白色固体,微溶于冷水,不溶于乙醇,化学性质与过氧化钠类似。某学习小组设计在碱性环境中利用CaCl2与H2O2反应制取CaO2·8H2O,装置如图所示:

回答下列问题:
(1)小组同学查阅文献得知:该实验用质量分数为20%的H2O2溶液最为适宜。市售H2O2溶液的质量分数为30%。该小组同学用市售H2O2溶液配制约20%的H2O2溶液的过程中,使用的玻璃仪器除玻璃棒、胶头滴管外,还有___。
(2)仪器X的主要作用除导气外,还具有的作用是___。
(3)在冰水浴中进行的原因是___。
(4)实验时,在三颈烧瓶中析出CaO2·8H2O晶体,总反应的离子方程式为___。
(5)反应结束后,经过滤、洗涤、低温烘干获得CaO2·8H2O。下列试剂中,洗涤CaO2·8H2O的最佳选择是____。
A.无水乙醇 B.浓盐酸 C.Na2SO3溶液 D.CaCl2溶液
(6)若CaCl2原料中含有Fe3+杂质,Fe3+催化分解H2O2,会使H2O2的利用率明显降低。反应的机理为:
①Fe3+ +H2O2=Fe2++H++HOO·
②H2O2+X=Y +Z+W(已配平)
③Fe2++·OH=Fe3++OH-
④H+ +OH-=H2O
根据上述机理推导步骤②中的化学方程式为___。
(7)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙具有____的性质。
A.与水缓慢反应供氧 B.能吸收鱼苗呼出的CO2气体
C.能是水体酸性增强 D.具有强氧化性,可杀菌灭藻
(8)将所得CaO2·8H2O晶体加热到150~160℃,完全脱水后得到过氧化钙样品。
该小组测定过氧化钙样品中CaO2的纯度的方法是:准确称取0.4000g过氧化钙样品,400℃以上加热至完全分解成CaO和O2(设杂质不产生气体),得到33.60mL(已换算为标准状况)气体。
则:所得过氧化钙样品中CaO2的纯度为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。

(1)若加入的试剂①为NaOH,加入试剂①的目的___。
(2)操作a的名称为过滤、洗涤,所需要的玻璃仪器为烧杯、___。
(3)加入的试剂③为___(填化学式),发生的离子反应方程式为___。
(4)固体E的成分为Fe和Cu,写出E和加入试剂④所发生的离子反应方程式为__。
(5)从溶液D和溶液G中得到FeSO47H2O晶体的操作为蒸发浓缩、冷却结晶、__、洗涤、干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g) ![]() 1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
②CaSO4(s)+CO(g) ![]() CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
③CO(g)![]() 1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
(1)反应2 CaSO4(s)+7CO(g) ![]() CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H=_______________(用△H1、△H2和△H3表示)。
CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H=_______________(用△H1、△H2和△H3表示)。
(2)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入__________________。
(3)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生成CaSO4,该反应的化学方程式为___________;在一定条件下CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是一些烷烃的燃烧热,则下列表达正确的是
化合物 | 燃烧热/ kJ·mol-1 | 化合物 | 燃烧热/ kJ·mol-1 |
甲烷 | 891.0 | 正丁烷 | 2878.0 |
乙烷 | 1560.8 | 异丁烷 | 2869.6 |
丙烷 | 2221.5 | 异戊烷 | 3531.3 |
A. 正戊烷的燃烧热大于3531.3 kJ·mol-1
B. 相同质量的烷烃、碳的质量分数越大,燃烧放出的热量越多
C. 正丁烷转化为异丁烷的热化学方程式为:CH3CH2CH2CH3(g) ![]() CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1
CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1
D. 甲烷燃烧的热化学方程式为:CH4(g)+2O2(g) ![]() CO2(g) +2H2O(g) △H =-891.0kJ·mol-1
CO2(g) +2H2O(g) △H =-891.0kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】将1mol CH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体 (101 kPa,120℃),其总质量为72g,下列有关叙述不正确的是
A. 若将产物通过碱石灰,则不能全部被吸收,若通过浓琉酸,则不能全部被吸收
B. 产物的平均摩尔质量为42g/mol
C. 若将产物通过浓硫酸充分吸收后恢复至101kPa,120℃,则压强变为原来的1/3
D. 反应中消耗氧气为56g
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学学习小组采用下列装置,对浓硝酸与木炭的反应进行探究。
已知:4HNO3![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
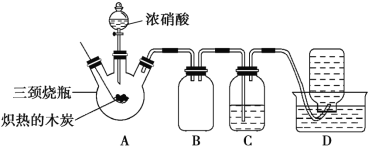
请回答下列问题:
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至红热状态,立即伸入三颈烧瓶中,并塞紧瓶塞,滴加浓硝酸,可观察到三颈烧瓶中气体的颜色为____,产生该气体的主要化学反应方程式是_____。
(2)装置C中盛有足量Ba(OH)2溶液,反应一段时间后可观察到C中出现白色沉淀,该白色沉淀为____(填化学式)。其中的Ba(OH)2溶液___(填“能”或“不能”)用Ca(OH)2溶液代替,理由是_____。
(3)装置B的作用是___。
(4)装置D中收集到了无色气体,部分同学认为是NO,还有部分同学认为是O2。
①下列对该气体的检验方法合适的是__(填序号)。
A.敞口观察集气瓶内气体的颜色变化
B.将润湿的蓝色石蕊试纸伸入集气瓶内,观察试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果集气瓶中收集到的无色气体是氧气,则氧气的来源是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关氧化还原反应的叙述正确的是( )
A.化学反应中电子转移的表示方法
B.离子M2O7x-与S2-能在酸性溶液中发生如下反应:M2O7x-+3S2-+14H+=2M3+ +3S +7H2O,则M2O7x-中M的化合价为+7
C.在常温下发生以下几个反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O②2A2++B2=2A3++2B-③2B-+Z2 =B2+2Z-根据上述反应,可知道氧化性强弱顺序为:XO4->Z2>B2>A3+
D.已知硝酸铵在一定温度下分解为5NH4NO3=4N2↑+2HNO3+9H2O↑,被氧化的元素和被还原的元素的质量之比为1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】甲氧基肉桂酸乙基己酯(图中J)是一种理想的防晒剂,能有效吸收紫外线,安全性良好。其合成线路图如下:

回答下列问题:
(1)由A生成B的反应类型为___。有机物E的分子式为___。丙二酸的结构简式为___。
(2)C的结构简式为___。
(3)H的结构简式为___。
(4)G与氢气反应可得X( )。X有多种同分异构体,其中同时满足下列条件同分异构体的结构简式为:___。
)。X有多种同分异构体,其中同时满足下列条件同分异构体的结构简式为:___。
①核磁共振氢谱有四种峰;②与FeCl3溶液能发生显色反应,且1mol该物质恰好能与3molNaOH完全反应。
(5)以乙醇和丙二酸为原料合成聚巴豆酸乙酯 ,请补充完成以下合成路线(无机试剂可任选)。
,请补充完成以下合成路线(无机试剂可任选)。
____
查看答案和解析>>
科目: 来源: 题型:
【题目】水体中硝酸盐造成的污染已成为突出的环境问题。某课题组研究了去除不同各种水体中NO3-的方法。
(1)用铝粉去除饮用水中NO3-的一种方案如下:

①用熟石灰而不用NaOH调节pH的主要原因是___。在调节pH时,若pH过大或过小都会造成Al的利用率降低。写出pH过大造成Al利用率降低的离子方程式___。
②在加入铝粉去除NO3-的反应中,氧化产物和还原产物的物质的量之比为___。
(2)用铁粉处理pH=2.5的含NO3-废水,测得溶液中相关离子浓度、pH随时间的变化关系如图(部分副反应产物略去):

①t1时刻前,该反应的离子方程式为___。
②研究表明:铁粉还原含NO3-废水时,加入活性碳粉可以提高去除NO3-的速率,可能的原因是___。
(3)用Pt作电极电解含NO3-的酸性废水,原理如图。N为电源的___(选填“正”或 “负”)极,与直流电源M端相连的Pt电极上的电极反应式为___。

(4)课题组以钛基氧化物涂层材料为惰性阳极、碳纳米管修饰的石墨为阴极,控制一定条件,电解含大量NO3-、SO42-的废水,可使NO3-变为NH4+。研究发现:其他条件不变,废水中加一定量NaCl,去除NH4+的效果明显提高,溶液中氮元素含量显著降低,可能的原因是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某一反应体系中有反应物和生成物共5种物质:H2S+HNO3→S+NO+H2O;下列说法中正确的是( )
A.该反应中的还原产物是S
B.若反应过程中转移了0.3 mol 电子,则氧化产物的质量9.6g
C.氧化剂与还原剂的物质的量之比为2∶3
D.反应后溶液的酸性明显增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com