
科目: 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。下列说法不正确的是( )
A.还原性:NaN3 > N2
B.若有65 g NaN3参加反应,则生成的N2的物质的量为1.6 mol
C.每转移1 mol电子,可生成标准状况下N2的体积为35.84 L
D.被还原的N与被氧化的N为15 :1
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)热化学方程式C(s) + H2O(g) ![]() CO(g) + H2(g);△H = +131.3 kJ/mol表示________
CO(g) + H2(g);△H = +131.3 kJ/mol表示________
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C. 1mol固态碳和1mol水蒸气反应生成1mol一氧化碳气体和1mol氢气,并吸收131.3kJ 热量
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
(2)下列离子方程式中,属于水解反应的是_______________
A、CH3COOH+H2O![]() CH3COO— + H3O+ B、CO2+H2O
CH3COO— + H3O+ B、CO2+H2O![]() HCO3— + H+
HCO3— + H+
C、CO32— + H2O![]() HCO3— + OH— D、HS— + H2O
HCO3— + OH— D、HS— + H2O![]() S2— + H3O+
S2— + H3O+
(3)有A、B、C、D四块金属片,进行如下实验,
①A、B用导线相连后,同时插入稀H2SO4中,A极为负极
②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D
③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡
④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为___________
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
(4)在一定条件下,下列反应:2SO2 (g)+O2 (g)=2SO3 (g) ΔH<0达到平衡状态
①该反应的化学平衡常数表达式是__________________________
②其他条件不变时降低温度,二氧化硫的转化率______________,(填“增大”、“不变”、“减少”)化学反应速率_________________(填“增大”、“不变”、“减少”)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列判断正确的是( )
A.可用水来确定某氧化钠粉末中是否含有过氧化钠
B.可用二氧化碳来确定某氧化钠粉末中是否含有过氧化钠
C.可利用在空气中加热的方法除去氧化钠中的过氧化钠
D.将足量的过氧化钠、氧化钠分别加到酚酞溶液中,最终溶液均为红色
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于新制氯水的叙述正确的是( )
A.光照新制氯水有气泡逸出,该气体是Cl2B.新制氯水放置数天后酸性减弱
C.新制氯水中只含有Cl2和H2O两种分子D.新制氯水可使蓝色石蕊试纸先变红后褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)、 一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
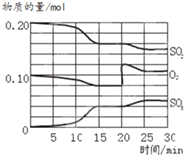
(1)降低温度,SO2的转化率_________,化学反应速度_________。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是_________。
(3)反应进行至20 min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a. 加了催化剂 b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
(二) 在一个固定体积的密闭容器中,充入 2 mol A 和1 mol B,发生如下反应:2 A(g) + B(g)![]() 3C(g) + D(s), 反应达到平衡时 C的浓度为1.2 mol/L。
3C(g) + D(s), 反应达到平衡时 C的浓度为1.2 mol/L。
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为_____反应(填“吸热”或“放热”)反应。
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是____________(用序号填空)
① 4 mol A + 2 mol B ② 3 mol C + 1 mol D + 1 mol B
③ 3 mol C + 2 mol D ④ 1.6 mol A + 0.8 mol B + 0.6 mol C
查看答案和解析>>
科目: 来源: 题型:
【题目】向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系不正确的是
A. ![]() B.
B. ![]() C. n=m+17Vc D.
C. n=m+17Vc D. ![]() m<p<
m<p<![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列变化不可能通过一步反应直接完成的是
A. Al(OH)3 → Al2O3 B. Al2O3 → Al(OH)3
C. Al → AlO2- D. Al3+ → Al(OH)3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均与Ag+反应生成沉淀),由图1可确定首先沉淀的是C-
B.图2表示反应中某反应物的正、逆反应速率随温度变化的情况, 由图可知该反应的正反应是吸热反应
C.图3表示一定条件下,X(g)![]() Y(g)+Z(s)中物质的量分数随起始投料比变化。m点对应的X转化率为33.3%
Y(g)+Z(s)中物质的量分数随起始投料比变化。m点对应的X转化率为33.3%
D.图4表示常温下稀释pH相同的HA与盐酸时溶液pH与加入水体积的关系,则HA为弱酸,且a点Kw的数值比b点的大
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)、某研究性学习小组,为了探究电极与原电池的电解质之间关系,设计了下列实验方案:用铝片、铜片、镁片作电极,分别与下列溶液构成原电池,并接电流表。
(1)若电解质溶液为0.5mol/L硫酸,电极为铜片和铝片,铝片上的电极的反应式为_________;
(2)若用浓硝酸作电解质溶液,电极为铜片和铝片,铝片为____极(填“正”或“负”)。正极上发生的电极反应式为_________;
(3)若电解质溶液为0.5mol/L氢氧化钠溶液,电极为镁片和铝片,则正极发生的电极反应为______。
(二)、肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和H2O,放出热量624kJ(25℃时),N2H4完全燃烧的热化学方程式是_______________________________________。肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼一空气燃料电池放电时:正极的电极反应式是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)在密闭容器中,保持一定温度进行如下反应:N2(g)+3H2(g) ![]() 2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3,回答下列问题:
2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3,回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=___________。
(2)平衡常数K值越大,表明建立平衡时___________(填序号)。
A. N2的转化率越高 B. NH3的产量越大
C. 正反应进行得越彻底 D. 化学反应速度越快
(3)a与b的关系是:a ____ b(填>、<、=)
(二)在密闭容器中发生下列反应: I2(g)+H2(g)![]() 2HI(g)(正反应吸热)
2HI(g)(正反应吸热)
起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变(“增大”“减小”或“不变”)填入相应的表格。
编号 | 反应条件 | 反应速率 |
① | 升高温度 | ______ |
② | 再充入a mol H2 | _______ |
③ | 将容器容积扩大为原来2倍 | _______ |
④ | 容积不变通入b mol Ne(g) | _______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com