
科目: 来源: 题型:
【题目】铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态,铈的合金耐高温,可以用来制造喷气推进器零件。
请回答下列问题:
(1)雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1:1),该反应氧化剂与还原剂的物质的量之比为________。
(2)可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。
①Ce4+从电解槽的______(填字母序号)口流出。
②写出阴极的电极反应式________________。
(3)铈元素在自然界中主要以氟碳矿形式存在。主要化学成分为CeFCO3。工业上利用氟碳铈矿提取CeCl3的一种工艺流程如下:

①焙烧过程中发生的主要反应方程式为__________________。
②有同学认为酸浸过程中用稀硫酸和H2O2替换盐酸更好,他的理由是_________。
③Ce(BF4)3、KBF4的Ksp分别为a、b,则Ce(BF4)3(s)+3KCl(aq)![]() 3KBF4(s)+CeCl3(aq)平衡常数为________(用a、b的代数式表示)。
3KBF4(s)+CeCl3(aq)平衡常数为________(用a、b的代数式表示)。
④加热CeCl3·6H2O和NH4Cl的固体混合物可得固体无水CeCl3,其中NH4Cl的作用是______。
查看答案和解析>>
科目: 来源: 题型:
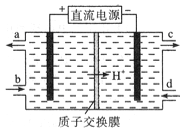
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法不正确的是

A. 电极a和电极c都发生氧化反应
B. 电极d的电极反应式为2H++2e-=H2↑
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 装置A中每消耗64gSO2,理论上装置A和装置B中均有2moH+通过质子交换膜
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学为测定Na2CO3固体(含少量NaCl)的纯度,设计如下装置(含试剂)进行实验。

下列说法不正确的是
A. 必须在②③间添加吸收HCl的装置
B. ④的作用是防止空气中的气体影响实验的精确度
C. 通入空气的作用是保证②中产生的气体完全转移到③中
D. 称取样品和③中产生的沉淀的质量即可求算Na2CO3固体的纯度
查看答案和解析>>
科目: 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
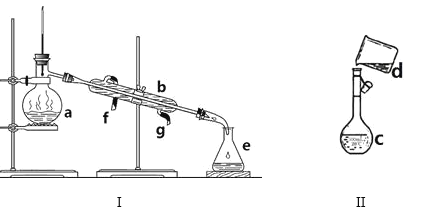
(1)写出下列仪器的名称:b. ___________。
(2)仪器c使用前必须_________________。
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是_________。
(4)用质量分数为98%、密度为1.84 g/cm3的浓H2SO4来配制480 mL、0.3 mol·L-1的稀H2SO4。
①装置Ⅱ是某同学转移溶液的示意图,图中的错误是_____________________。除了图中给出的的仪器外,为完成实验还需要的仪器有:___________________。
②根据计算得知,需量取该浓H2SO4的体积为_______________mL。
(5)下列操作,会使所配制的溶液浓度偏大的是____________。
①容量瓶中原来含有少量蒸馏水;
②在未降至室温时,立即将溶液转移至容量瓶定容
③定容转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度
④定容时俯视刻度线;
⑤用量筒量取98%的硫酸时俯视
查看答案和解析>>
科目: 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是
选项 | 实验 | 现象 | 结论 |
A | 向添有KIO3的食盐中加入淀粉溶液、稀盐酸及KI | 溶液变蓝色 | 氧化性:IO |
B | 向稀氨水和酚酞混合溶液中加入少量Ag2O,振荡 | 溶液由浅红色变为红色 | Ag2O是强碱 |
C | 向装有经过硫酸处理的CrO3(桔红色)的硅胶导管中吹入乙醇蒸气 | 固体逐渐由桔红色变为浅绿色(Cr3+) | 乙醇具有还原性 |
D | 向盛有少量水的烧杯中加入少量Mg2Si | 产生白色沉淀,液面上有火苗 | Mg2Si水解生成Mg(OH)2和SiH4 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯),下列说法正确的是( )
Si(纯),下列说法正确的是( )
A.步骤①的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
B.步骤①、②、③中每生成或反应1 mol Si,转移4 mol电子
C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D.SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目: 来源: 题型:
【题目】研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到直观形象的效果,下列表达不正确的是( )
A. NaOH溶液与SO2反应时溶液中溶质的情况 ![]()
B. NaAlO2溶液与盐酸反应后铝的存在形式![]()
C. Fe在Cl2中燃烧产物![]()
D. Fe和稀硝酸反应后,铁的存在形式![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】由Al、CuO、Fe2O3组成的混合物共10.0g,放入500mL某浓度的盐酸中,混合物完全溶解,当再加入250mL 2.00mol/L的NaOH溶液时,得到沉淀最多。上述盐酸的浓度为( )
A. 1.00 mol/LB. 0.500 mol/L
C. 2.00 mol/LD. 3.00 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
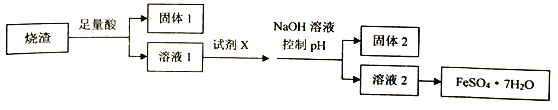
下列说法不正确的是
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2;控制pH是为了使Al3+转化为A1(OH)3进入固体2
C. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
D. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
查看答案和解析>>
科目: 来源: 题型:
【题目】向200 mL FeBr2溶液中逐渐通入Cl2,其中n(Fe 3+)、n(Br2) 随通入n(Cl2)的变化如图所示,下列说法不正确的是( )

A.氧化性强弱:Br2 > Fe3+
B.由图可知,该FeBr2溶液的浓度为1 mol·L-l
C.n(Cl2)=0. 12 mol时,溶液中的离子浓度有c (Fe 3+)∶c( Br-)=1∶8
D.n(FeBr2)∶n(Cl2)=1∶1时,反应的离子方程式为:2Fe2++2Br- + 2Cl2=2Fe3++Br2 + 4Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com